Пассивность металлов
Явление пассивности, впервые открытое М.В. Ломоносовым, имеет очень большое практическое значение в металлургии, и, особенно, для защиты металлов от коррозии. На его принципах существует целая отрасль металлургии – коррозионностойкие стали (хромистые, хромоникелевые, хромомолибденовые, и т.п.) и сплавы (алюминиевые, никелевые, титановые и т.д.).
Пассивность (пассивное состояние) – состояние относительно высокой коррозионной стойкости, вызванное торможением анодной реакции ионизации металла в определенной области потенциала. Скорость коррозии сталей и сплавов при переходе в пассивное состояние может понижаться на несколько порядков (рис. 4.20).
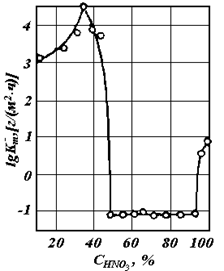
Рис. 4.20. Зависимость логарифма скорости коррозии железа от концентрации HNO3 при 200С.
М. Фарадеем было доказано, что явление пассивности имеет электрохимическую природу. Он разработал пленочную теорию пассивности, согласно которой в ходе анодной реакции образуется тонкая невидимая оксидная плёнка, сильно замедляющая анодный процесс. Согласно этой теории пассивные плёнки - тонкие беспористые плёнки оксидов с относительно высокой электронной, но низкой ионной проводимостью. Последнее условие обязательно, т.к. на железе в электролитах при определённых условиях могут образовываться слои толстых рыхлых кислородсодержащих соединений, не обладающих защитными свойствами. Плёночная теория применима ко многим металлам (Al, Ni, Cr, Ti, редкие тугоплавкие металлы). Образование пассивных пленок обусловлено анодной реакцией образования оксида в присутствии H2O:
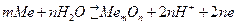 . (4.90)
. (4.90)
Адсорбционная теория пассивности (А.Н. Фрумкин) состоит в том, что поверхностные атомы металла связываются с молекулами H2O адсорбционной связью, прочность которой увеличивается с ростом потенциала.
Плёночно - адсорбционная теория, объединяя предыдущие, дополняет их возможностью нахождения под плёнкой и в порах хемосорбированных ионов кислорода.
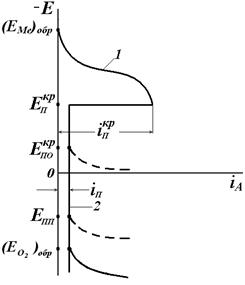
Основной метод изучения пассивности металла – потенциостатический, т.е. получение электрохимической зависимости скорости растворения металла от потенциала с использованием потенциостата, когда металлу задается потенциал и фиксируется ток. Типичная анодная поляризационная кривая приведена на рис. 4.21.
Другим методом получения поляризационных зависимостей является гальваностатической метод, при котором задается ток, а регистрируется изменение потенциала.
а б
Рис.4.21. Обобщённая анодная потенциостатическая поляризационная кривая при пассивации металла (а). Характерные потенциалы: 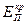 – критический потенциал пассивации,
– критический потенциал пассивации, 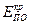 – критический потенциал питтингообразования,
– критический потенциал питтингообразования, 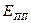 – потенциал перепассивации,
– потенциал перепассивации, 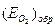 – обратимый потенциал выделения О2. Характерные токи:
– обратимый потенциал выделения О2. Характерные токи: 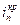 – критический ток пассивации,
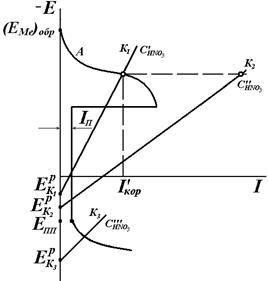
– критический ток пассивации, 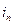 – ток пассивного состояния; б – схема поляризационной коррозионной диаграммы, поясняющая самопассивацию Fe в HNO3.
– ток пассивного состояния; б – схема поляризационной коррозионной диаграммы, поясняющая самопассивацию Fe в HNO3.
На рис. 4.21, а приведена обобщенная анодная поляризационная Е – i кривая. Здесь 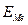 в отсутствии внешнего тока равен
в отсутствии внешнего тока равен 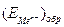 . На кривой выделяется область активного растворения металла (1) и область пассивности (2). Потенциал активно-пассивного перехода применительно к обобщенной кривой называется критическим потенциалом пассивации
. На кривой выделяется область активного растворения металла (1) и область пассивности (2). Потенциал активно-пассивного перехода применительно к обобщенной кривой называется критическим потенциалом пассивации 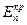 , а соответствующий ему максимальный ток активного растворения – критическим током пассивации
, а соответствующий ему максимальный ток активного растворения – критическим током пассивации 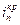 . Начальный участок кривой 1 описывается тафелевской зависимостью, и дальнейшие отклонения от неё связаны с началом процесса пассивации. В области 2 величина тока пассивации iп не зависит от потенциала. Для некоторых оксидов металлов с высокой электронной проводимостью (Fe, Ni) при увеличении потенциала до обратимого потенциала кислородного электрода
. Начальный участок кривой 1 описывается тафелевской зависимостью, и дальнейшие отклонения от неё связаны с началом процесса пассивации. В области 2 величина тока пассивации iп не зависит от потенциала. Для некоторых оксидов металлов с высокой электронной проводимостью (Fe, Ni) при увеличении потенциала до обратимого потенциала кислородного электрода 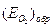 возможна реакция выделения кислорода. На хроме при более отрицательном потенциале, чем
возможна реакция выделения кислорода. На хроме при более отрицательном потенциале, чем 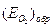 , наступает активное растворение хрома в виде
, наступает активное растворение хрома в виде 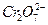 или
или 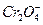 анионов. Этот процесс называемся перепассивацией. Для хрома перепассивация имеет важное практическое значение для коррозии хромистых и хромоникелевых сталей в сильных окислителях.
анионов. Этот процесс называемся перепассивацией. Для хрома перепассивация имеет важное практическое значение для коррозии хромистых и хромоникелевых сталей в сильных окислителях.
Условие (4.90) не является достаточным для пассивации конкретного металла. Например, в растворах HNO3 переход железа в пассивное состояние зависит от концентрации HNO3 (рис. 4.21, б). Катодная кривая К1 (восстановление HNO3) пересекает анодную кривую А в области активного растворения при низкой концентрации 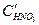 . С увеличением концентрации
. С увеличением концентрации 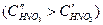 катодная кривая К2 пересекает анодную в пассивной области, так что скорость коррозии металла
катодная кривая К2 пересекает анодную в пассивной области, так что скорость коррозии металла 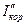 равна току пассивности
равна току пассивности 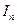 . Различие в ходе катодных кривых К1 и К2 объясняется скоростью протекания реакции:
. Различие в ходе катодных кривых К1 и К2 объясняется скоростью протекания реакции:
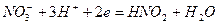 . (4.91)
. (4.91)
Для более высокой концентрации, 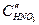 , скорость реакции выше, торможение реакции и перенапряжение катода меньше. Коррозия Fe здесь начинается с активного растворения Fe, и, когда ток растворения превосходит критический ток пассивности
, скорость реакции выше, торможение реакции и перенапряжение катода меньше. Коррозия Fe здесь начинается с активного растворения Fe, и, когда ток растворения превосходит критический ток пассивности 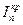 , металл переходит в пассивное состояние. При достаточно низких концентрациях кислоты коррозия Fe будет протекать с высокой скоростью, а при достаточно высоких концентрациях железо пассивируется. При очень высоких
, металл переходит в пассивное состояние. При достаточно низких концентрациях кислоты коррозия Fe будет протекать с высокой скоростью, а при достаточно высоких концентрациях железо пассивируется. При очень высоких 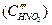 снова возможен рост в области перепассивации Fe. Эта зависимость скорости роста коррозии Fe от концентрации HNO3 хорошо объясняет экспериментальные данные (рис. 4.20).
снова возможен рост в области перепассивации Fe. Эта зависимость скорости роста коррозии Fe от концентрации HNO3 хорошо объясняет экспериментальные данные (рис. 4.20).
Пассивация металла может быть достигнута: 1) созданием условий для самопроизвольной пассивации в присутствии окислителей, 2) анодной поляризацией металла до потенциалов пассивной области.
При изменении внешних условий пассивный металл может перейти в активное состояние. Факторами активации (депассивации) металла являются:
1) присутствие восстановителей (водорода, солей Na2SO3, Na2S2O8 и др.);
2) катодная поляризация от внешнего источника постоянного тока или контакт пассивного металла с металлами, являющимися анодом;
3) влияние некоторых ионов (H+, или Cl- на пассивный металл);
4) повышение температуры;
5) механическое нарушение пассивной поверхности металла, например, царапание, если металл не находится в пассивирующей среде.
Дата добавления: 2017-02-13; просмотров: 3406;











