РАССЕЯНИЯ В МЕДИЦИНСКОЙ ДИАГНОСТИКЕ
ЛАЗЕРНАЯ СПЕКТРОСКОПИЯ КВАЗИУПРУГОГО
Под лазерной спектроскопией квазиупругого рассеяния (ЛСКР) понимается совокупность методов когерентной диагностики для изучения динамических характеристик биологических микрообъектов: коэффициентов диффузии, скоростей – как направленного перемещения биожидкостей, так и усредненных (миграционного движения), – а также параметров микроперемещений (внутриклеточной и молекулярной подвижности).
Основу методики ЛСКР составляет извлечение информации о рассеивающей среде посредством регистрации амплитуды и фазы (частоты) рассеянного излучения. Временные изменения параметров квазиупруго рассеянного излучения проявляются в изменении его корреляционной функции, или, что то же самое, в изменении его частотного спектра. «Квазиупругость» означает, что волновой вектор рассеянной волны отличается от падающей только направлением, а изменением его модуля можно пренебречь. В зависимости от характера движения рассеивателей оптический вектор оптический спектр (изначально представляющий собой квазимонохроматическую волну от когерентного лазерного источника) либо уширяется, либо приобретает характерные сдвинутые по отношению к падающему излучению частотные компоненты.
Поскольку скорости движения частиц в потоках биожидкостей малы, возникающие уширения и сдвиги составляют ничтожно малую долю основной частоты (от 10 Гц до 10 МГц), и зарегистрировать их традиционными спектроскопическими методами – даже с использованием, например, многолучевой интерференционной спектрометрии – не представляется возможным. Так, интерферометр Фабри-Перо способен различить смещение частоты, как правило, не менее 10 МГц, да и то в уникальных случаях, при работе не в основном максимуме, а в побочных. Используя же оптическое смешение, ставшее практически осуществимым только с появлением лазеров (см. Гл.13), можно преобразовать оптические сигналы в электрические с соответствующим переносом анализа спектра с несущих частот порядка 1014 Гц в нулевые. А в этом случае 10 МГц – это не мало, а очень даже много, поскольку радиочастотные анализаторы спектра электрических сигналов могут работать с разрешением до долей Гц.
Суть метода оптического смешения – в том, что падающее и рассеянное излучение смешиваются (или, выражаясь на жаргоне специалистов по квантовой электронике, сбиваются) в некоторой области пространства и дают интерференционную картину с пространственным распределением интенсивности. Если бы частоты смешиваемых сигналов совпадали, то картина распределения интенсивностей, определяемая фазовыми соотношениями между сигналами, была бы неподвижной. Это составляет основу голографии. Но в силу того, что из-за движения рассеивающих частиц появляются допплеровские сдвиги частот, интерференционная картина движется. Если в области смешения поместить квадратичный фотодетектор, то он зарегистрирует как постоянную засветку (результат смешения колебаний с совпадающими частотами), так и переменные составляющие с разностными частотами, как раз и образующие в совокупности информативный радиочастотный спектр. Первый эксперимент, в котором наблюдались биения между модами неон-гелиевого лазера (Форрестер, 1961), был не лишен экстравагантности: поскольку частоты биений укладывались в звуковой диапазон, экспериментатор записал их на обычный магнитофон и демонстрировал «поющий лазер». Правда, «пение» было не слишком мелодичным (частота биений испытывала флуктуации, напоминающие музыку либо совершенно лишенного слуха начинающего композитора, либо супермодерниста на грани пребывания в психушке), но дело было сделано: оптическое смешение из умственного изыска превратилось в научно установленный факт.
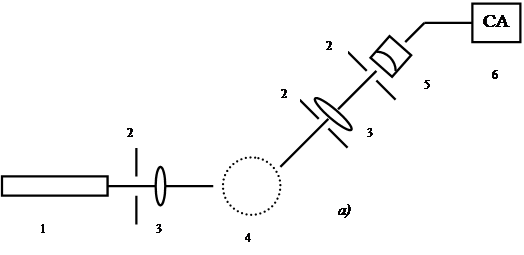
Лазерные спектрометры оптического смешения обычно подразделяют на гомодинные и гетеродинные ( см. рис. 28.1).
 | |
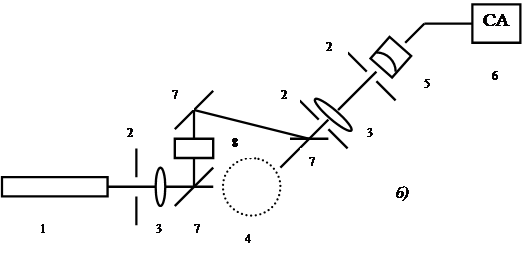 |
Рис. 28.1
Схемы лазерных спектрометров оптического смешения:
а) гомодинного, б) гетеродинного:
1- лазер, 2 – диафрагмы, 3 – линзы, 4 – исследуемая среда, 5 – фотоприемник, 6 – аппаратура для анализа спектра фототока, 7- зеркала, 8 – устройство регулируемого смещения частоты лазера (акустооптический модулятор).
Как видно, основное различие гомодинной и гетеродинной схем оптического смешения — в том, что в первом случае выделяются биения между различными частотными компонентами самого рассеянного излучения, а во втором на фотоприемник направляется опорный сигнал, представляющий собой часть падающего на исследуемый объект излучения.
Гомодинная схема более проста, но ее возможности ограничены. В самом деле, для наблюдения спектра сигнала биений требуется, чтобы волны, рассеянные различными частицами исследуемого биообъекта, попадали на площадку приемника по возможности в фазе, т.е. в пределах угла когерентности. Это накладывает жесткие требования на размер регистрирующей площадки фотоприемника, который не должен превышать половины интерференционной полосы. Поэтому, с одной стороны, уместно ограничивать размер засвечиваемой области, с другой – формировать приемную апертуру в пределах угла когерентности 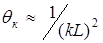 , где L – характерный поперечник зондируемой области. В спектре фототока присутствуют три компоненты: постоянная составляющая, дробовый шум засветки лазером и спектр флуктуаций интенсивности регистрируемого излучения, несущий полезную информацию. Основной недостаток гомодинной схемы заключается в том, что спектр полезного сигнала перекрывается спектрами различных низкочастотных шумов, как дробового, так и прочих, связанных с нестабильностью частоты самого лазера. Учитывая, что при гомодинном смешении интенсивность полезного сигнала мала (определяется произведением амплитуд смещенных компонент), выделение полезного сигнала на фоне низкочастотных шумов является нетривиальной задачей.
, где L – характерный поперечник зондируемой области. В спектре фототока присутствуют три компоненты: постоянная составляющая, дробовый шум засветки лазером и спектр флуктуаций интенсивности регистрируемого излучения, несущий полезную информацию. Основной недостаток гомодинной схемы заключается в том, что спектр полезного сигнала перекрывается спектрами различных низкочастотных шумов, как дробового, так и прочих, связанных с нестабильностью частоты самого лазера. Учитывая, что при гомодинном смешении интенсивность полезного сигнала мала (определяется произведением амплитуд смещенных компонент), выделение полезного сигнала на фоне низкочастотных шумов является нетривиальной задачей.
В значительной мере удается преодолеть эти трудности как раз при гетеродинном смешении, поскольку интенсивность полезного сигнала в спектре фототока оказывается пропорциональной интенсивности опорного пучка. Кроме того, частота полезного сигнала может быть заданным образом смещена в сторону высоких частот за счет перестройки частоты опорного излучения. Часто в качестве источника опорного излучения используется второй лазер, частота которого заданным образом завязана с первым. Собственно, именно при наличии самостоятельного источника опорного сигнала гетеродинная схема отвечает в полной мере своему названию, поскольку делает процесс выделения полезного сигнала в спектре фототока полностью независимым от флуктуаций зондирующего излучения. Чтобы отличить случай автономного источника от случая отведения части мощности зондирующего лазера в качестве опорного сигнала, употребляют для последнего варианта название «автодинный режим». (Не путать с гомодинным!)
Благодаря возможности «вытаскивания» амплитуды полезного сигнала до нужной величины и сдвига спектра фототока в область малых шумов гетеродинная методика позволяет в принципе реализовать квантовый предел чувствительности регистрирующей фотоприемной аппаратуры. Пределом чувствительности при возрастании интенсивности опорного сигнала является дробовый шум засветки самим опорным сигналом. Такой режим работы гетеродинного спектрометра оптического смешения (СОС) называется режимом идеального гетеродинирования. Хотя для гетеродинного СОС условия когерентности при сбитии пучков на площадке фотоприемника не менее жесткие, чем для гомодинного, юстировочные трудности окупаются указанными принципиальными преимуществами. Более того, предельная чувствительность гетеродинного СОС в пересчете на спектральную плотность регистрируемого сигнала может превышать квантовый предел. Собственно, сам квантовый предел, означающий счет отдельных фотонов, является понятием философским. Отдельный фотон может быть зарегистрирован в течение различных промежутков времени, что и означает, что спектральная плотность может быть, вообще говоря, сделана сколь угодно малой.
Еще одна особенность оптического гетеродинирования, отличающая эту методику от классических измерительных методик – это возможность регистрации предельно малых полезных сигналов на фоне больших паразитных засветок. Блестящим примером такого рода был проведенный в начале 70-х годов эксперимент по измерению спектральной плотности солнечного излучения в диапазоне 10,6 мкм с помощью гетеродинной схемы на базе СО2-лазера. Оценка по формуле Планка показывает, что спектральная плотность излучения Солнца в этом диапазоне составляет не более 10-4 от максимальной (приходящейся, как известно, на зеленую область видимого спектра). Любой счетчик фотонов, даже если представить себе, что он может «поймать» фотон с длиной волны 10,6 мкм (а это может быть только либо тепловой фотодетектор, либо фотоприемник на внутреннем фотоэффекте), будет неминуемо «ослеплен» более коротковолновым излучением столь «неудобного» источника. Гетеродинный же приемник преспокойно воспринимает излучение с такой длиной волны, поскольку сигнал биений формируется вблизи частоты генерации опорного лазера.
Наиболее развитым направлением разработок медицинской аппаратуры, основанной на СОС, являются приборы для анализа гемодинамики, т.е. для измерения различных характеристик потоков крови. Исторически первые измерения скорости кровотока in vivo были сделаны в начале 70-х годов, причем измерялся артериальный кровоток, имеющий наибольшую направленную компоненту (1-2 м/с). Однако распространения в медицинской практике такие приборы не получили, поскольку получаемые при анализе артериального кровотока допплеровские сдвиги оптических частот ( ~ 107-108 Гц) оказываются слишком большими для того, чтобы их можно было измерять простейшими средствами. Требования к быстродействию фотоприемной аппаратуры и средств цифровой обработки сигнала в радиочастотной области оказываются весьма жесткими. Кроме того, измерения характеристик артериального кровотока очень критичны к положению оптического датчика на поверхности тела, состоянию поверхности кожи, усилию прижатия и т.п., что делает воспроизводимость результатов недопустимо низкой. Поэтому лазерные допплеровские измерители артериального кровотока не получили распространения на практике.
В последующие годы центр тяжести разработок сместился в сторону анализа капиллярного кровотока. В этом случае допплеровский спектр занимает существенно меньшую полосу частот ( в пределах 103 Гц). В настоящее время приборы для анализа капиллярного кровотока выпускаются серийно в ряде стран, в т.ч. в России, и получили достаточно широкое распространение в практике медицинских учреждений.
В качестве примера рассмотрим устройство лазерного доплеровского анализатора капиллярного кровотока (ЛАКК) фирмы Perimed (Швеция). Эта фирма выпускает подобные приборы уже более 20 лет и пользуется заслуженным международным авторитетом. Блок-схема прибора показана на рис. 28.2.
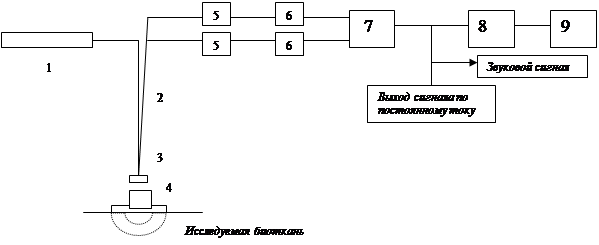
Рис.28.2.
Блок-схема лазерного анализатора капиллярного кровотока:
1 – неон-гелиевый лазер (λ = 0,6328 мкм), 2 – световодный кабель. 3 – измерительная головка, 4 – термостатированный держатель, 5 – фотоприемник, 6 – предварительный усилитель, 7 – дифференциальный усилитель, 8 – АЦП, 9 - ЭВМ
Прибор работает по гомодинной схеме. Через волоконно-оптический световод излучение передается на измерительную головку. Когда головка находится в контакте с биотканью, свет проникает в ткань, испытывает многократное диффузное отражение, преломляется и постепенно поглощается. Этот процесс обрисовывает характерную область практически полусферической формы в полупространстве, непосредственно прилегающем к торцу головки. Все эритроциты, проходящие через эту область, подвергаются воздействию света, частично отражают его, в результате чего появляется допплеровский сдвиг. Тем самым диффузно отраженное излучение, выходящее наружу и улавливаемое приемными световодами, представляет собой смесь как несмещенных по частоте, так и испытавших допплеровский сдвиг компонент. Амплитуды и частоты этих компонент связаны с количеством эритроцитов, проходящих через область взаимодействия, и их скоростями, но фактически не зависят от направления движения отдельных эритроцитов (регистрируется усредненная, или дрейфовая, скорость). Приемные световоды доставляют излучение к фотоприемникам, преобразующим оптический сигнал в электрический.
Спектр фототока представляет собой совокупность разностных допплеровских частот, сдвинутых с оптической частоты в нуль. Этот спектр носит случайный характер и содержит информацию о распределении движущихся эритроцитов по скоростям. Правда, требуется уточнение, что это относится только к тем эритроцитам, которые проходят через область взаимодействия (полусферу радиусом около 1 мм с центром, совпадающим с центром торца измерительной головки, или торцом излучающего световода). Здесь уместно вспомнить об основном недостатке гомодинной схемы. Средняя скорость капиллярного кровотока составляет ~ 10-11- 10-12 от скорости света. Соответственно такую же часть составляет допплеровский сдвиг относительно основной частоты световой волны. В абсолютных значениях это ~ 102-103 Гц. Чтобы проанализировать подобный спектр, требуется стабильность частоты лазера, в обычных условиях недостижимая (лазер, не имеющий специальных устройств, не способен обеспечить стабильность частоты лучше 1 Мгц, да и то не в условиях клиники, а в научной лаборатории). В приборах для анализа капиллярного кровотока применено остроумное решение этой проблемы, заключающееся в разбиении принимаемого сигнала на два канала (сигнал биений принимается двумя группами фотодиодов 3×2 и подается на дифференциальный усилитель). В результате низкочастотные шумы, связанные с флуктуациями частоты лазера и не связанные с доплеровским смещением, вычитаются.
Выделенный доплеровский сигнал поступает на микропроцессорное устройство и используется для компенсации флуктуаций интенсивности и разброса коэффициентов пропускания световодов. Параллельно с компенсацией сигнал поступает на ЭВМ для преобразования в наиболее удобную для изучения форму. Так, в приборе фирмы Perimed выводимая на дисплей величина выражается в единицах потока эритроцитов. Возможны выделения и других характеристик кровотока.
В принципе методика измерений с помощью ЛАКК предполагает, что исследуемая область целиком пронизывается кровеносными сосудами, и движение эритроцитов изотропно. Измерения носят относительный характер, главным образом выявляя отклонения от нормы. Постоянная времени измерения здесь может быть выбрана достаточно малой (£ 0,2 с), а дифференциальная методика регистрации позволяет реализовать высокую чувствительность и воспроизводимость.
Особенности работы доплеровского ЛАКК:
- результат критичен к перемещениям измерительной головки, которая в процессе измерения должна быть достаточно плотно прижата к поверхности исследуемой ткани и зафиксирована относительно этой поверхности (желательно с калиброванным усилием, чтобы не влиять неконтролируемо на интенсивность кровотока);
- результат критичен к температуре исследуемой области, поэтому устройство должно обеспечиваться термостатированной измерительной головкой (так, в приборе фирмы Perimed температура поддерживается в диапазоне 26-40о С.) Термостатирование необходимо примерно по той же причине, что и калиброванное усилие при контакте с поверхностью (при изменениях температуры возможны локальные изменения кровотока, не связанные с патологией);
- необходимо помнить, что ЛАКК измеряет характеристики потока рассеивающих частиц (дискретных), но непригоден для анализа характеристик непрерывного потока (с частицами, малыми по сравнению с длиной волны). Поэтому, например, для лимфы или плазмы крови прибор неприменим.
Приборы типа ЛАКК нашли весьма обширную сферу применения (ожоговая терапия, дерматология, гериатрия, экспресс-диагностика патологий периферического кровообращения при системных заболеваниях, неврология, оккупационная медицина и т.д.). Единственная пока не перекрытая этой методикой сфера – это эндоскопический контроль кровоснабжения внутренних органов.
Поскольку полуширина доплеровского спектра капиллярного кровотока не превосходит 1 кГц, что соответствует интенсивности нормальной микроциркуляции, такие приборы реализованы в виде компактных настольных конструкций, имеющих малые габариты и вес и снабженных набором специальных аксессуаров.
Возвращаясь к проблеме анализа артериального кровотока, следует признать очевидным, что для анализа кровотока, имеющего ярко выраженную направленную скорость, прибор типа ЛАКК не годится. Для выделения направленной компоненты необходимо измерять не ширину спектра, центрированную на нулевой частоте, а выделять пик с максимумом на частоте, соответствующей скорости направленного перемещения. Здесь необходима не гомодинная, но гетеродинная схема. Проблемы, возникающие при ее реализации, связаны с двумя обстоятельствами: критичность к смещению исследуемой области относительно точки фокусировки и необходимость использования широкополосной усилительной аппаратуры (с пропусканием минимум до 10 МГц). Кроме того, наблюдаемый пик в допплеровском спектре испытывает заметный сдвиг максимума при наблюдении кровотока цельной и разбавленной крови, а также при изменении диаметра исследуемых сосудов. Ошибки тут связаны с двумя факторами: вкладом многократного рассеяния и возмущениями кровотока вблизи стенок сосудов или торца датчика. Несущественные в случае капиллярного кровотока, эти ошибки становятся весьма значительными при анализе направленного кровотока. Поэтому практическая реализация приборов для анализа артериального кровотока (ЛААК) оказалась значительно сложнее, чем ЛАКК. Разработки тем не менее продолжаются, и наступивший XXI век, безусловно, продемонстрирует успешное применение на практике как приборов для анализа артериального, так и венозного кровотока.
Лазерные допплеровские анализаторы кровотока – типичный, но далеко не исчерпывающий пример медицинской аппаратуры, использующей когерентную спектроскопию оптического смешения. Большое число исследований и разработок посвящено регистрации подвижности живых клеток (сперматозоидов, бактерий и т.п.). Эта подвижность носит не тепловой характер (подобно капиллярному кровотоку), а характер случайных блужданий типа броуновского движения с элементами поступательного и вращательного перемещений (в т.ч. случайных «заплетаний» и «расплетаний»). Описание светорассеяния в таких случаях выливается в сложные многопараметрические математические модели. Здесь решающую роль играет использование ЭВМ и выработка соответствующих алгоритмов обработки сигнала. Составной частью комплекса аппаратуры является пакет программ сбора и обработки данных, а также для управления ходом измерений. Это направление разработок пока не нашло широкой практической реализации в силу повышенной наукоемкости и сложности аппаратуры. Тем не менее приборы подобного типа регулярно появляются на международных выставках, что свидетельствует о неослабевающем интересе к их разработкам.
В заключение упомянем еще один тип лазерной аппаратуры для когерентной диагностики: лазерные допплеровские микроскопы (ЛДМ).
Все приборы, рассмотренные выше, работают на анализе эффектов, обусловленных многими одинаковыми частицами ( в т.ч. анализаторы даже внутриклеточной подвижности, но не внутри конкретной отдельной клетки, а усредненной по многим аналогичным ). Если же необходимо исследовать именно конкретную клетку, то необходим ЛДМ. Одна из реализованных в отечественной практике схем ЛДМ показана на рис. 28.3.
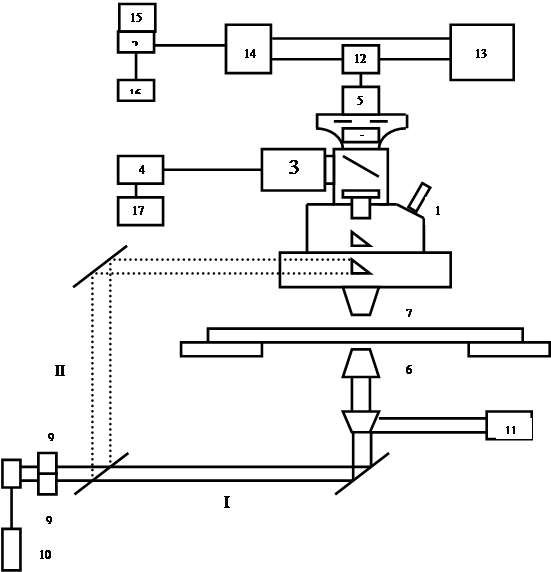 |
Рис. 28.3
Блок-схема лазерного доплеровского микроскопа. Пояснения в тексте
Микроскоп 1 сопряжен с ЭВМ 2 и снабжен видеокамерой 3 с дисплеем 4. В данном случае был использован микроскоп типа «Люмам», позволяющий реализовать дифференциальную схему с опорным пучком ІІ, вводя пучок в поле перекрытия сбоку через смесительное зеркало. Если же такой возможности нет, то можно ограничиться однолучевой схемой І. В дифференциальном случае фотоприемник 5 регистрирует свет, рассеянный назад по отношению к опорному пучку, в однолучевом – вперед. Измерительный объем формируется фокусирующим 6 и приемным 7 объективами и точечной диафрагмой 8. До попадания на фокусирующий объектив оба пучка проходят через акустооптические модуляторы 9, в результате чего они приобретают относительный сдвиг частоты Δf , который можнорегулировать в широком диапазоне (от 102 до 106 Гц). Сигнал с фотоприемника 5 усиливается предварительным усилителем 12 и поступает на ЭВМ 2 (параллельно он может наблюдаться на спектроанализаторе 13). ЭВМ выдает соответствующие сигналы на выводные устройства (дисплей 15, принтер 16). Анализ поступающей информации может вестись как в режиме реального времени, так и a posteriori. Размер измерительного объема для типичных объективов 15× и 30× и диаметре диафрагмы 8 в 150 мкм составляет Ø7,5×2,5 мкм.
Подобная конструкция ЛДМ позволила получить ряд уникальных результатов по регистрации направленных движений внутри одиночных клеток. Благодаря лазерной доплеровской микроскопии стало возможным прямое экспериментальное решение задач субклеточной биофизики, имеющих огромное значение для современной медицины.
| <== предыдущая лекция | | | следующая лекция ==> |
| Оценка продольного размера спекла по методу Гюйгенса-Френеля | | | РАССЕЯНИЯ. МОДЕЛЬ КИРХГОФА. |
Дата добавления: 2017-01-26; просмотров: 841;










