Аппаратура для лазерной ангиопластики.
Под лазерной ангиопластикой (ЛА) понимается восстановление просвета кровеносных сосудов о помощью лазерного излучения. Вообще ангиопластика — это возможный путь решения практически всех проблем кардиологии, поскольку состояние сосудистого русла непосредственно связано со всеми патологиями этой важнейшей системы жизнеобеспечения, держащими печальную пальму первенства по части смертности. Как известно, совокупность явлений, приводящих к сужению и полному перекрытию просвета сосудов, обобщенно именуется склерозом. Склероз на ранних стадиях представляет собой образование налетов на стенках сосудов, напоминающих жировые сгустки (липидные бляшки), затем наблюдается уплотнение бляшек, превращение жировой ткани в соединительную и прорастание ее на всю толщину стенки сосуда (фиброзные бляшки), в последующем происходит насыщение бляшек минеральными солями (кальцинированные бляшки), причем в кальцинозной стадии бляшки становятся похожими на камень и по твердости существенно превосходят здоровые ткани, наконец, в последней стадии (посткальцинозной) склеротическая ткань теряет механическую прочность, и стенки сосудов (вернее, то, что от них осталось) фактически рассыпаются от малейшего воздействия. До посткальцинозной стадии дело доходит редко, поскольку наибольшее количество фатальных последствий склероза имеет место в фиброзной и кальцинозной стадиях (инфаркты, инсульты, гангрены, аневризмы).
Проблема борьбы с атеросклерозом существует столько, сколько существует медицина. Учитывая, что развитие цивилизации усугубляет причины, вызывающие склеротические явления, во второй половине нашего столетия эта проблема неуклонно обостряется. Пожалуй, ни в одну отрасль медицины не вкладывались такие силы и средства, как в кардиологию, но результаты, увы, далеко не оправдывают затрат.
Способов восстановления просвета сосудов существует несколько. Не затрагивая терапевтических, остановимся коротко на хирургических. Прежде всего — это шунтирование и протезирование пораженных участков сосудов. На сегодня техника хирургических операций на сосудах достигла высокой степени развития, и в принципе таким способом можно восстановить кровообращение большинства жизненно важных органов (кроме, пожалуй, мозга, где сосудистое протезирование и шунтирование пока не применяются ввиду исключительной сложности и непредсказуемости результатов операции).
Однако нельзя забывать, что такие операции являются исключительно сильным воздействием на организм, которое в состоянии перенести далеко не каждый пациент. При сосудистой операции для воздействия на патологический объект, размеры которого исчисляются миллиметрами, приходится рассекать целые пласты если не совершенно здоровых, то, во всяком случае, нормально функционирующих тканей, которые к тому же принадлежат жизненно важным органам (сердце, легкие, печень, почки и т.д.).
В качестве примера, причем весьма характерного для современной сердечно-сосудистой хирургии, можно привести операцию аортально-коронарного шунтирования (АКШ), в ходе которой конструируется запасной путь кровотока в обход закупоренной коронарной артерии, питающей сердечную мышцу. Такая операция проводится на остановленном сердце, с применением аппаратуры искусственного кровообращения (АИК) и специального операционного микроскопа, длится не менее 3 часов (если не встретились особые осложнения) и требует высочайшей квалификации персонала, поскольку одно неверное движение ведет к тяжелым последствиям с высокой вероятностью летальности. Стоимость такой операции, по американским оценкам, колеблется от 20 до 100 тысяч долларов. Но даже если не упоминать денежный фактор, то спасти от инфаркта таким способом удается не более 10% тех людей, которым он угрожает, не говоря уже о том, что после операции АКШ человек должен соблюдать весьма строгий режим, мало отличающийся от инвалидности. Так что хирургическое лечение — наиболее эффективное из всех существующих — увы, сопряжено с такими затруднениями, что никак не может рассматриваться в качестве пути спасения человечества от сердечно-сосудистых заболевании. Это, разумеется, выяснилось не сегодня и не вчера, поэтому поиск альтернативных методов лечения ведется постоянно.
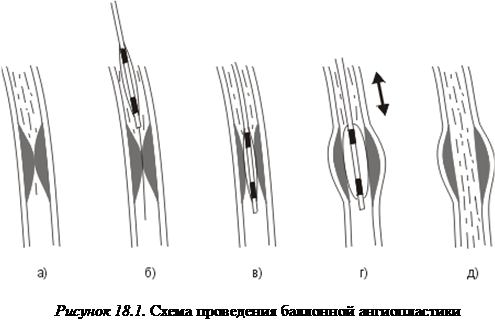 |
Ангиопластика (поначалу без лазеров) рассматривалась как весьма обнадеживающий способ лечения атеросклероза, находящийся на стыке хирургии и терапии. В ангиопластике главным инструментом врача является катетер, позволяющий достигать патологического объекта (бляшки или тромба) путем продвижения по сосудистому руслу. Катетер вводится пункционно в каком-то месте, где крупная артерия близко подходит к поверхности тела. Чаще всего это паховая, подключичная или подмышечная области, реже — область шеи. В 60-е годы получила бурное развитие баллонная ангиопластика, остающаяся на вооружении до сих пор (рисунок 18.1).
Баллонная ангиопластика может сочетаться с предварительным протыканием окклюзии (перекрывающего кровоток образования) с помощью металлического проводника, но подобное радикальное воздействие должно проводиться с ювелирной точностью и эффективно только на достаточно прямых участках сосудов. Интересны ангиопластические методики, в которых вместо протыкания используется «просверливание» окклюзии с помощью высокооборотного «микробура», вращающегося со скоростью до 100 тыс. оборотов в минуту. При таких больших скоростях вращения вокруг бура образуется область жидкости, передающая воздействие на объект, так что устройство получается гидродинамическим. Кроме того, бур самоцентрируется, что весьма важно при передаче вращения по гибкому валу. С помощью такого внутрисосудистого «бурения» удавалось восстановить просвет сосуда на протяжении окклюзии более полуметра (бедренно-подколенная артерия).
Однако, несмотря на успехи описанных методов механической ангиопластики, все они имеют принципиальный недостаток. Неизбежная при механическом воздействии деформация тканей прилежащих стенок сосудов приводит, как правило, к неблагоприятным последствиям. На месте «содранной» бляшки быстро растет новая (при этом скорость роста бляшки-рецидивиста существенно превышает скорость естественных склеротических процессов), и через полгода-год механическую ангиопластику приходится повторять, но уже в гораздо более сложном варианте, поскольку площадь поврежденной внутренней поверхности сосуда (интимы) велика по сравнению с площадью первичной «сдираемой» бляшки.
Кроме того, бляшки в процессе механической ангиопластики чаще вовсе и не «сдираются», поскольку, начиная с фиброзной стадии, это просто невозможно сделать, а восстановление просвета сосуда происходит просто за счет «выпучивания» внешних стенок сосуда. Очевидно, что последствиями такого воздействия будут: а) повторное сужение просвета в том же месте за счет упругих свойств стенок, и б) увеличение размеров бляшки по протяженности, поскольку при баллонировании сильнее повреждается здоровая ткань, нежели фиброзная. В результате первая перерождается в последнюю. Таким образом, блестящая по остроумию идея ангиопластики находит явно не самую адекватную реализацию в случае механического воздействия.
Поэтому, когда в начале 80-х появилось предложение D. Choy использовать при ангиопластике лазерное излучение, это вызвало большой энтузиазм как у врачей, так и у разработчиков медицинской техники. Еще бы — ведь при воздействии на патологию лазерным излучением открываются исключительные возможности.
Во-первых, ни с чем не сравнимая локальность воздействия. Передаваемое через гибкий световод лазерное изучение воздействует на объект с прецизионностью, определяющейся поглощением излучения биотканью и геометрией световода. Во-вторых, возможно разрушение любых типов бляшек, в том числе кальцинированных, что для механической ангиопластики недоступно. В-третьих, минимальные механические повреждения сулят отсутствие травматических рецидивов и рекордно малый период реабилитации. Вместе с главными достоинствами долазерной ангиопластики (пункционный доступ в сосуды, отсутствие необходимости общего наркоза, использования АИК и прочей фундаментальной операционной техники, возможность оперативного контроля процесса воздействия с помощью визуализирующей аппаратуры) это, без всякого преувеличения, имеет значение наступающей новой эры в кардиологии.
Однако, как все принципиально новое, лазерная ангиопластика быстро проскочила период младенца-вундеркинда и встретилась со своими специфическими трудностями. В течение последних лет разработан ряд экспериментальных и опытных образцов установок для лазерной ангиопластики, но ни одна из них пока не освоена серийно (ни в нашей стране, ни за рубежом). То же относится и к медицинским применениям ЛА — число экспериментов исчисляется многими тысячами, а клинического освоения метода пока нет.
Каковы же основные проблемы, тормозящие внедрение лазерной ангиопластики в серийное производство и клиническую практику? Вкратце они сводятся к следующему:
— биологическое действие лазерного излучения изучено недостаточно, особенно в специфическом внутрисосудистом случае, поэтому оптимальный источник лазерного излучения пока не определен;
— остается открытым вопрос об оптимальной световодной системе, передающей излучение к объекту воздействия;
— оптические характеристики патологических и здоровых тканей различаются незначительно, поэтому обеспечить селективность воздействия лазерного излучения — весьма нетривиальная задача;
— необходима специальная катетерная техника, поскольку все попытки использовать при ЛА катетеры, разработанные для других применений, потерпели решительную неудачу. Вся сложность заключается в том, что катетер при лазерной ангиопластике оказывается исключительно перегруженным функциями, и его разработка и изготовление представляют серьезную технологическую задачу.
Решение перечисленных проблем требует усилий специалистов как медицинских, так и научно-технических профессий. Вместе с тем уже сегодня можно обрисовать, какая же должна быть установка для ЛА и тем самым доказать, что 20 лет интеллектуальных и прочих усилий не пропали зря, несмотря на все объективные и субъективные трудности.
Прежде всего — лазерный источник, «сердце» установки. Он должен содержать ряд особенностей, связанных именно с ангиопластической спецификой. Так, повреждение прилежащих к зоне облучения тканей должно быть минимальным. Значит, необходимо реализовать фотоабляционный режим. Хотя фотоабляция может быть реализована в принципе для любой длины волны, нежелателен длинноволновый участок видимого спектра и ближний ИК диапазон, поскольку здесь глубина проникновения излучения в ткань велика.
Даже в отсутствие теплопроводности воздействие оказывается недостаточно прецизионным, к тому же возрастает вероятность образования крупных частиц в процессе разрушения, что чревато закупоркой сосудов продуктами разрушения. Верхнюю границу допустимых размеров частиц можно установить, основываясь на требованиях, предъявляемых к работе АИК. Предварительные исследования показали, что частиц крупнее 80 мкм в сине-зеленом участке видимого спектра и в ближнем УФ диапазоне не образуется, но окончательный ответ на этот вопрос еще не получен.
Другое, весьма важное требование, непосредственно связанное c глубиной проникновения излучения в ткань, — это определение оптимального сочетания длины волны с параметрами импульса. С точки зрения снижения порога разрушения ткани более предпочтителен ближний УФ диапазон (300 – 350 нм). Согласно проделанным оценкам (Л.15), пороговая энергия в импульсе там примерно на порядок меньше, чем в зеленой области.
Однако малый порог — еще не все. Интересно сравнить, как различаются пороговые энергии для здоровой и патологической тканей. Оказывается, что в УФ диапазоне бляшку разрушить примерно вдвое труднее, чем здоровую ткань, а в зеленом — примерно на 30% легче, причем такая благоприятная селективность обнаруживается только в сине-зеленом диапазоне и больше нигде. Так что в принципе можно представить режим, при котором излучение лазера вообще не воздействует на здоровые ткани, но разрушает бляшки.
Наконец, еще один существенный фактор, влияющий на выбор лазерного источника, — это возможность передачи излучения через световод. Как мы помним, этот фактор обусловил разработку целого класса лазерных установок для эндоскопии на базе АИГ:Nd-лазеров, поскольку излучение СО2-лазеров, c успехом используемых в хирургии, через кварцевые световоды не передается. Но для ангиопластики мы уже забраковали ближний ИК диапазон, поэтому весь этот класс установок нельзя использовать. Остаются сине-зеленый и ближний УФ диапазоны, излучение которых допускает передачу через кварцевые световоды, но потери при этом существенно различаются. Лучшие образцы кварцевых световодов для УФ области имеют потери порядка 0.3 дб/м. Это значит, что при достижении пороговой плотности на выходе световода длиной 10 м на входе необходимо обеспечить вдвое большую плотность энергии. В зеленом же диапазоне потери составляют (2¸5)*10-2 дб/м, т.е. на порядок меньше. Тем самым потерями в материале здесь можно пренебречь.
Но потери в материале световода определяют не только необходимость увеличения энергия в импульсе на входе световода. Вмешивается куда более серьезный фактор — короткие импульсы, реализующие фотоабляцию, создают весьма высокую плотность мощности, приближающуюся к пределу радиационное стойкости световода. Типичная величала радиационной стойкости составляет 108 – 109 Вт/см2. При длительности импульса 10-8с этот предел превышается в зеленом диапазоне при энергии порядка 10 мДж и поперечном сечения пучка в несколько мм2. Для разрушения же бляшки требует энергия в импульсе (при условии использования световода с диаметром 400 – 600 мкм) не менее 100 мДж, а с учетом необходимости запаса для проведения различных операций — не менее 500 мДж, поскольку пороговая плотность энергии составляет 20–30 Дж/см2.
В свете этих оценок ряд авторов поспешили сделать вывод, что лазер зеленого диапазона для ангиопластики не перспективен. Поэтому значительные усилия были брошены на разработку установок на базе эксимерных лазеров. Как в нашей стране, так и за рубежом появились несколько моделей таких установок, но дальше опытных образцов дело не пошло. Обнаружилось, что короткие импульсы УФ излучения (10–15 нс) все равно разрушают световод, несмотря на их малую энергию. Разработчики пошли по пути удлинения импульсов, что является нетривиальной задачей, учитывая механизмы создания инверсии в эксимерных лазерах. Сегодня практически все установки подобного типа работают с растяжкой импульсов.
Но эксимерные лазеры имеют, кроме того, целый ряд принципиальных недостатков, которые сильно тормозят их внедрение в массовую медицинскую практику. Это большие габариты и вес, сложность конструкции и обслуживания, недостаточный ресурс, заставляющий использовать резервуары с рабочими газами, необходимость применения токсичных газовых компонент; к тому же ряд экспериментов заставил заподозрить повышенную цитотоксичность и мутагенность излучения этих лазеров, что особенно настораживает врачей.
В свете перечисленных трудностей (каждая из которых, взятая в отдельности, преодолима, но в совокупности они создают барьер солидной высоты) говорить о возможности внедрения ангиопластических установок на базе эксимерных лазеров в массовую кардиологическую практику в ближайшей перспективе не приходится.
Если обратиться к зеленому диапазону, то растяжка импульсов возможна здесь с таким же успехом, как и в УФ диапазоне. Только если для эксимерных лазеров применяется плавная растяжка, то для твердотельных более предпочтительна ступенчатая. Американские разработчики применили оптическую растяжку, при которой короткий импульс пропускается через интерферометр Фабри-Перо, превращаясь в «гребенку» (последовательность импульсов, суммарная энергия которых мало отличается от энергии первичного импульса, а общая длительность в зависимости от добротности используемого интерферометра может быть увеличена в сотни и тысячи раз). Отечественные разработчики достигли того же электронным путем, управляя оптическим затвором. Поскольку в зеленом диапазоне запас по длительности составляет 5 порядков, возможности ступенчатого расширения довольно широки.
В ходе экспериментальных исследований обнаружен интересный эффект, не нашедший пока однозначного объяснения. Именно, для эксимерных лазеров с увеличением длительности импульса падает пороговая плотность энергии разрушения бляшки. Аналогичных экспериментов в зеленом диапазоне, к сожалению, не проводилось, однако нет принципиальных запретов для перенесения эффекта в видимую область.
Тем самым, можно констатировать, что главная причина, запрещавшая использование для ангиопластики АИГ:Nd-лазера, работающего на длине волны 532 им, именно: невозможность передачи импульсов с необходимой плотностью энергии через световод, — кажущаяся. Во всех остальных отношениях преимущества твердотельного лазера, работающего на 2-й гармонике, — технологичность, экономичность, малогабаритность, надежность, простота управления, несравненно более высокая безопасность во всех отношениях ― неоспоримы. Напрашивается вывод о том, что лазер зеленого диапазона на базе Nd:YAG существенно ближе к оптимальному для ЛА источнику, чем лазеры других типов. Сегодня же, когда в медицину активно внедряются волоконные лазеры, можно констатировать, что в случае освоения ими сине-зеленого диапазона спектра они вытеснят из лазерной ангиопластики все конкурирующие типы. Окончательный ответ на вопрос об оптимальном источнике излучения может быть дан только при освоении промышленного выпуска установок для ЛА и их массовом медицинском применении.
Поиск оптимального источника — важная, но далеко не единственная проблема лазерной ангиопластики. Не менее важна проблема оперативной диагностики. Лазерная ангиопластика обладает той особенностью, что в ней нельзя разделить собственно лечение и диагностику, В ходе ангиопластической операции принципиально необходим оперативный контроль, представляющий не что иное, как экспресс-диагностику непосредственно в процессе воздействия. Поскольку время самого воздействия исчисляется секундами, средства позволяющие «видеть», что происходит в зоне облучения, должны обладать достаточным быстродействием. Для ЛА могут быть применены традиционные методы визуализации — рентгеновский и ультразвуковой. И тот, и другой не могут быть признаны удовлетворительными. Рентгеновская ангиография позволяет видеть кровеносный сосуд только поперек кровотока, т.е. как раз то, что необходимо видеть во время операции — поле облучения, находящееся перед торцом световода — она не показывает. Ультразвуковая ангиография еще менее пригодна — поперек кровотока она «видит» даже хуже, чем рентгеновская, а для наблюдения с торца нет достаточно миниатюрных датчиков, хотя сообщения о разработке таковых в литературе появляются.
Остается оптическая визуализация. Действительно, к ней в течение всего времени разработок установок для ЛА приковано самое пристальное внимание. Ключевым элементом системы оптической визуализации является многоволоконный оптический катетер (MОK), через который на объект передается зондирующее излучение, а от объекта к наблюдателю — принятый информативный сигнал. На сегодня опробованы три методики оптической визуализации: эндоскопическая, спектроскопическая и топологическая.
Устроим краткий обзор этих методик.
Эндоскопическая визуализация основана на стремлении непосредственно наблюдать внутренность кровеносного сосуда глазом. Разработан ряд моделей сверхтонких эндоскопов (ангиоскопов), главной частью которых является оптико-волоконный кабель для передачи изображения, содержащий от 2 до 4 тысяч тонких световодов с упорядоченным расположением, так что изображение объекта перед торцом кабеля, сформированное миниатюрным объективом, передается через световоды и затем рассматривается через окуляр. Лучшие образцы таких ангиоскопов позволяют проникать даже в коронарные артерии (внешний диаметр 1.8 мм). В зависимости от комплектации цена ангиоскопа составляет от 40 до 70 тыс. долл. С появления первых опытных образцов ангиоскопов прошло уже более 20 лет, но за это время все попытки внедрения ангиоскопии в медицинскую практику успеха не имели.
Причина — на поверхности. Кровь — классический пример непрозрачной среды, сквозь даже очень тонкий слой которой ничего не видно. Все попытки убрать кровь из поля зрения, находясь внутри кровеносного сосуда (нагнетание в поле зрения физиологического раствора, применение раздуваемых баллончиков, ухищрения по части различных оптических насадок на ангиоскопический объектив, просветляющих поле зрения) оказались несостоятельны — либо все равно ничего не видно, либо естественный ход физиологических процессов нарушается настолько грубо, что возникает реальная угроза жизни больного. Например, раздувание баллончика внутри коронарной артерии равносильно ее закупорке, т.е. как раз тому, чего ни в коем случае не следует допускать при росте бляшки, поскольку это является причиной инфаркта. Впрыскивание туда же физраствора для разбавления крови означает обеднение кровоснабжения сердечной мышцы, причем элементарный подсчет показывает, что для мало-мальски различимого наблюдения внутрисосудистых объектов в поле зрения надо вкачать столько физраствора, что этого не выдержит самое здоровое сердце, а ведь врач имеет дело c больным.
Эндоскопическая визуализация при ЛА — классический пример плохой постановки задачи для разработчиков. Затрачены огромные усилия, прежде всего — интеллектуальные, создано, в сущности, чудо технологии — гибкий эндоскоп с диаметром менее 2 мм и полной функциональной нагрузкой, вплоть до инструментального канала — и все зря.
К счастью, еще c 1985 г. ведутся альтернативные разработки. Так, исследователи из Массачусетского технологического института (США) разработали метод лазерной спектроскопии изображений (LSI). Этот метод основан на выявлении различий в спектрах флуоресценции нормальной и патологической тканей при возбуждении таковых лазерным излучением. Для возбуждения использовалось лазерное излучение как видимого, так и УФ диапазона (аргоновый лазер, 2-я и 3-я гармоники Nd:YAG-лазера, эксимерные лазеры). Флуоресценция собственно крови может быть исключена из рассмотрения при обработке принятых сигналов. Передача оптических сигналов от объекта к фотоприемнику осуществляется через МОК, каждое из волокон которого передает дискретную порцию информации, подвергаемую спектральному экспресс-анализу (рисунок 18.2).
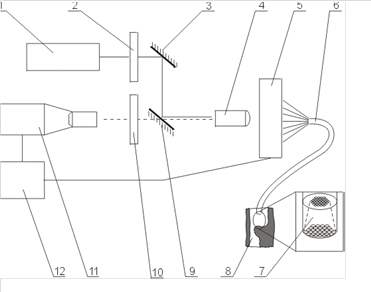 |
Рисунок 18.2. Схема внутрисосудистой визуализации по методу LSI: 1 – лазер, 2 –фильтр, 3 – зеркало, 4- система ввода излучения в световод, 5 – световодная линейка, 6 –многоволоконный оптический катетер (МОК), 7 – микрооптический наконечник МОК, 8 – биообъект, 9 – делительное зеркало, 10 – оптическая развязка, 11 – фотоприемное устройство, 12 – система обработки изображения, включающая многоканальный экспресс-анализатор спектра и персональный компьютер.
На основе этого анализа строится карта спектроскопических изображений исследуемой биоткани, выводимая на экран дисплея в виде условной картины поперечного сечения сосуда. Используемый здесь МОК существенно отличается от эндоскопического кабеля — в нем не 4000 волокон, а, в разных модификациях, от 19 до 34. Тем самым пространственное разрешение в методе LSI существенно ниже, чем в эндоскопическом. Но это вполне допустимо — угрожающим положение с ростом бляшек является при перекрытии сечения сосуда более, чем наполовину, поэтому информация в перекрытии не обязана быть излишне подробной. Вполне достаточно отслеживать нечто подозрительное с точностью около 20% от поперечного сечения, а для этого хватает тех самых 19 волокон, которые использовались в первом образце МОК для реализации метода LSI. Световедущий диаметр каждого из световодов МОК составлял 100 мкм. В зависимости от результата спектрального экспресс-анализа (норма — патология) в соответствующий канал посылается либо зондирующее излучение, либо разрушающее. Карта спектроскопических изображений все время перед глазами врача. Если ни в одном из каналов патологии нет, катетер продвигается вперед насколько возможно. Устойчивое отсутствие патологии на всем исследуемом протяжении означает успешное завершение операции.
Методика LSI, безусловно, представляет собой качественный скачок по сравнению с эндоскопией, прежде всего, по двум причинам:
а) чувствительность приема информативного излучения лимитируется не глазом, а фотоприемной системой;
б) открываются богатые возможности использования вычислительной техники. Отсюда следуют объективность диагноза, возможность радикального улучшения чувствительности, возможность извлечения информации всеми доступными ЭВМ способами, от выдачи данных экспресс-анализа спектра непосредственно в процессе операции в реальном масштабе времени до запоминания и хранения информации в памяти с любым способом ее обработки и извлечения нужных особенностей.
Однако и применение методики LSI не позволяет считать проблему визуализации решенной. Прежде всего, методика LSI, как нетрудно видеть, завязана на переработку большого объема информации. Даже при использовании самых современных компьютеров смена изображений происходит через несколько секунд, что вряд ли допустимо в реальных условиях ангиопластической операции.
Совершенствование алгоритмов обработки сигнала вряд ли сулит большой выигрыш в быстродействии, поскольку:
а) различие в спектрах флуоресценции патологической и нормальной тканей слишком мало для уверенной дифференциации показаний;
б) опрос приемных каналов МОК не может быть сделано слишком быстрым.
Практически реализованная вероятность обнаружения патологии составляет 60–70%. Этого явно недостаточно для того, чтобы окупить затраты на разработку и внедрение LSI-методики. После первых экспериментов по LSI прошло уже более 25 лет, но освоения методики в медицинской практике пока не видно.
Разработчики LSI-методики в течение 90-х годов связывали определенные надежды в части повышения вероятности обнаружения патологии с переходом от флуоресцентной спектроскопии к спектроскопии вынужденного комбинационного рассеяния, которая в отечественной науке связывается с именами Мандельштама и Бриллюэна, а в западной — Рамана. Эти надежды оправдали себя не более, чем люминесцентная методика. В любом случае подсистема оперативной диагностики, основанная на LSI, является сложной и дорогостоящей и потому малопригодной для широкой медицинской практики.
Обратимся к третьей возможности оптической визуализации — топологической методике. Возможность визуализации в соответствии с пространственным распределением интенсивности сигнала, диффузно отраженного внутрисосудистыми объектами, анализировалась на ранних стадиях разработки LSI и была отвергнута как малочувствительная, не дающая приемлемой вероятности распознавания патологии и неудовлетворительная с точки зрения спектрального диапазона. Однако сегодня следует признать такую оценку несколько преждевременной.
Проведенные исследования показали, что топологическая методика, основанная на координатно-чувствительной локации (КЧЛ — см. рисунок. 18.3), позволяет оценивать диагностическую ситуацию не хуже, чем при LSI, но гораздо более простыми средствами и более оперативно. Остановимся на этой методике несколько подробнее.
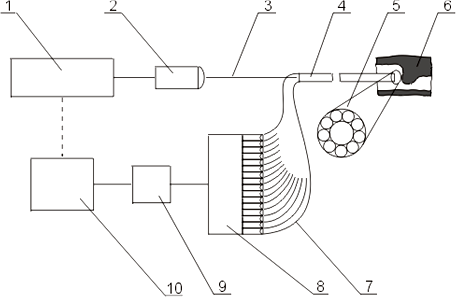 |
Рисунок 18.3. Схема внутрисосудистой визуализации по методу КЧЛ: 1 – лазер, 2 – устройство ввода излучения в зондирующий световод, 3 – зондирующий световод, 4 – многоволоконный оптический катетер (МОК), 5 – поперечное сечение МОК в области микрооптического наконечника, 6 – биообъект, 7 – приемные световоды, 8 – фотоприемное устройство (линейка из фотодиодов, каждый из которых согласован со своим приемным световодом), 9 – система обработки сигнала, 10 – персональный компьютер.
Оцениваемое изображение объекта можно представить в виде некоторой функции двух переменных f(x,y), отражающей распределение светового потока в рассматриваемом сечении. Процесс регистрации этого светового потока системой отдельных волокон можно рассматривать в первом приближении как дискретизацию, поставив каждому волокну в соответствие точку на плоскости Р(х,y). Функции f'(x,y) поставим в соответствие двумерный Фурье-спектр:
F(u,v)=òòP dx dy f(x,y) e-i(ux+vy) (18.1)
f(x,y)=òòQ du dv F(u,v) ei(ux+vy)/4p
В соответствии с классикой спектр F(u,v) ограничен и равен нулю за пределами некоторой области Q (рисунок 18.4а).
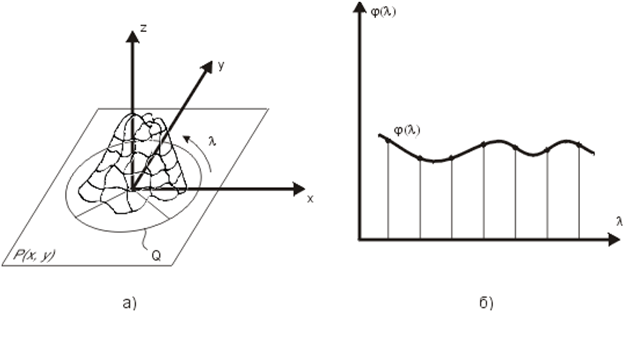 |
Рисунок 18.4. Представление двумерного фурье-спектра в виде одномерной функции при построении алгоритма обработки изображения по методу КЧЛ.
Без ограничения общности можно положить, что существует единичная область G(u,v), где F(u,v)¹0. Тогда можно воспользоваться теоремой Котельникова, сообразно которой функция f(x,y) может быть без потерь восстановлена по дискретному набору отсчетов по осям x и y, взятых с достаточно малым шагом Dx и Dy. Обозначим функцию дискретизации Y(х,y), а ее Фурье-спектр Z(u,v). Тогда спектр дискретизированного сигнала запишется в виде свертки:
Fg(u,v)=F(u,v)* Z(u,v) (18.2)
Основной интерес в проводимой операции представляют ограничения, накладываемые на функцию дискретизации Y(x,y). Эти ограничения вытекают из физических соображений. Y(x,y) должна без искажений передавать центральную часть F(u,v), прилегающую к точке (u=0, v=0). В реальной ситуации не ставится задача реконструкции изображения полностью. Важно усмотреть различия изображений, даваемых различными функциями f1(x,y) и f2(x,y), т.е. требуется МОК, функция дискретизации которого Y(x,y) позволит воспроизвести фрагмент пространственной спектральной области L, в которой проявляются существенные различия спектров F1(u,v) и F2(u,v).
Чтобы установить, какие различия следует рассматривать как существенные, смоделируем процесс роста бляшки с точки зрения МОК. Бляшка растет из стенки в просвет сосуда, постепенно перекрывая кровоток. С точки зрения МОК это представляет собой искажение боковой поверхности цилиндра при наблюдении вдоль оси. В этом случае двумерную функцию f(x,y) можно заменить на одномерную j(l), зависящую от параметра обхода по окружности l (рис. 19.4б). Параметр l определяет границы просвета сосуда в поле зрения катетера.
Реконструкция изображения, тем самым, сводится к задаче аппроксимации функции j(l) по набору отсчетов j(li), полученных каждым из каналов МОК. Но специфика задачи позволяет сделать дальнейшие упрощения. Функция j(l) — периодическая с периодом l0, соответствующим длине окружности обхода. В этом случае теорема Котельникова предписывает не ряд, а конечную сумму, причем максимальный номер гармоники М, на которой можно оборвать ряд, определяется числом волокон МОК, расположенных вдоль окружности обхода. Но главные различия в топологии наблюдаемых изображений как раз появляются при обходе по окружности.
Тем самым, задавая набор эталонных картин, эквивалентных той или иной диагностической ситуации, можно определить минимальное (точнее, минимально необходимое) число волокон при концентрической упаковке МОК. Такая оценка наиболее адекватна с позиций теории распознавания образов. Методология этой теории требует введения пространства параметров, системы ядер классификации (набор условных изображений просвета сосуда) и решающего правила для отнесения объекта к одному из обозначаемых классов.
Для определения достоверности принятого решения следует использовать аппарат теории вероятностей. Введя функцию расстояния Ri( 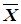 ) в пространстве параметров между вектором исследуемого объекта
) в пространстве параметров между вектором исследуемого объекта 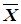 и каждымиз ядер
и каждымиз ядер 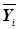 , будем оценивать принадлежность изображения к определенному классу по минимуму функции расстояния:
, будем оценивать принадлежность изображения к определенному классу по минимуму функции расстояния:
Ri( 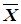 ,
, 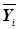 ) = {
) = { 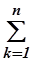 (xk–yik)2}1/2, k=0,1...n (18.3)
(xk–yik)2}1/2, k=0,1...n (18.3)
Для минимизации функции расстояния воспользуемся классическими формулами статистической радиотехники. Если вектор наблюдения 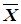 содержит гауссову аддитивную ошибку
содержит гауссову аддитивную ошибку 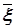 , то вероятность того, что наблюдаемый объект можно отождествить с ядром
, то вероятность того, что наблюдаемый объект можно отождествить с ядром 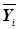 , равна:
, равна:
Wj=W( 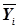 /
/ 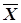 )=
)= 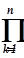 w(xk–yk) (18.4)
w(xk–yk) (18.4)
где w(xk-yk) — вероятность «отклонения» по каждой из компонент вектора 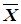 (x0...xn) от
(x0...xn) от 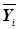 (yi0...yin), задаваемая интегралом вероятности F(xk–yik). Задача, тем самым, состоит в установлении системы ядер классификации, наиболее соответствующих медицинской специфике, выявлении принадлежности наблюдаемого объекта к определенному классу и определении степени достоверности принятого решения. Очевидно, суммарная вероятность
(yi0...yin), задаваемая интегралом вероятности F(xk–yik). Задача, тем самым, состоит в установлении системы ядер классификации, наиболее соответствующих медицинской специфике, выявлении принадлежности наблюдаемого объекта к определенному классу и определении степени достоверности принятого решения. Очевидно, суммарная вероятность 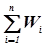 должна равняться единице, если система ядер классификации выбрана корректно.
должна равняться единице, если система ядер классификации выбрана корректно.
Наиболее типичной — и уже поэтому наиболее неприятной — является ситуация, в которой максимальная вероятность Wi далека от приемлемой (а для практических нужд вероятность обнаружения патологии должна быть не меньше 80%). Поэтому необходима разработка адаптивного алгоритма, напоминающего рейтинговую многоступенчатую систему выборов. В первом туре при огромном числе кандидатов никто из них не набирает необходимого большинства. Во втором туре остаются только те кандидаты, которые набрали не менее «порогового» процента голосов. Повторяя процедуру столько раз, сколько понадобится для достижения необходимого большинства (меняя по дороге «пороговый» процент), выявляется наиболее достойный из кандидатов.
Кроме того, значение порога достоверности, вообще говоря, зависит от номера ядра классификации, поскольку важность принятия соответствующих решений различна. Здесь существует опасность если не «зацикливания» алгоритма, то резкого увеличения времени выдачи диагностических рекомендаций. Априори заданная функция Р( 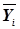 ), описывающая зависимость величины порога достоверности от номера ядра классификации, может оказаться нереализуемой в процессе наблюдения конкретных объектов, т.е. точность измерения координат вектора xk окажется недостаточной для того, чтобы отличить его от другого вектора xj. Вводя дисперсию шума N0, можно установить критерий различимости двух объектов
), описывающая зависимость величины порога достоверности от номера ядра классификации, может оказаться нереализуемой в процессе наблюдения конкретных объектов, т.е. точность измерения координат вектора xk окажется недостаточной для того, чтобы отличить его от другого вектора xj. Вводя дисперсию шума N0, можно установить критерий различимости двух объектов 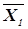 и
и 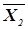 :
:
R( 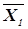 ,
, 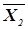 )
)
| <== предыдущая лекция | | | следующая лекция ==> |
| Лазерное излучение в нейрохирургии. | | | Аппаратура для лазерной литотрипсии. |
Дата добавления: 2017-01-26; просмотров: 1980;











