Строение атома и элементарные частицы
За единицу заряда принимается элементарный заряд
е=1,60×10-19 Кл.
За единицу массы принимается 1/12 часть массы изотопа углерода с массовым числом 12. Эта единица называется атомной единицей массы (сокращенно а.е.м.);
1 а.е.м. = 1,66×10-27 кг.
Масса наилегчайшего атома – атома водорода – равна 1,008 а.е.м.
За единицу энергии принимается электрон-вольт (эВ)
1 эВ=1,60×10-19 Дж.
Моменты импульсов частиц выражаются в единицах 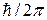 , магнитные моменты электронов – в единицах
, магнитные моменты электронов – в единицах 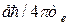 , магнитные моменты ядер – в единицах
, магнитные моменты ядер – в единицах  .
.
В этих выражениях: 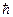 – постоянная Планка, е – элементарный заряд, те – масса электрона, тр – масса протона. Единица
– постоянная Планка, е – элементарный заряд, те – масса электрона, тр – масса протона. Единица 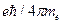 называется магнетоном Бора,
называется магнетоном Бора, 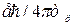 – ядерным магнетоном.
– ядерным магнетоном.
Магнетон Бора 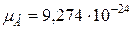 А×м2 .
А×м2 .
Ядерный магнетон 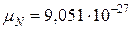 А×м2.
А×м2.
В центре атома находится положительно заряженное ядро, вокруг которого вращаются по определенным орбитам электроны. Основная масса атома (99,95-99,97 %) сосредоточена в ядре.
Ядро самого легкого атома – водорода 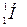 – состоит из одного протона. Масса протона – 1,672×10-27 кг, нейтрона – 1,675×10-27 кг, электрона – 9,11×10-31 кг(1/1836 часть массы протона).
– состоит из одного протона. Масса протона – 1,672×10-27 кг, нейтрона – 1,675×10-27 кг, электрона – 9,11×10-31 кг(1/1836 часть массы протона).
Заряд электрона и протона равен элементарному электрическому заряду e. Положительный заряд протона равен по абсолютному значению элементарному заряду. Число элементарных зарядов ядра равно порядковому номеру элемента в Периодической системе Менделеева. Количество электронов в атоме (нейтральном) равно числу элементарных зарядов ядра.
Движение электронов в атоме можно приближенно описывать как движение вокруг ядра по определенным круговым и эллиптическим орбитам (рис. 1.1). Эти орбиты называют стационарными. Двигаясь по стационарным орбитам электрон, несмотря на наличие у него ускорения, не излучает. Радиусы стационарных круговых орбит определяются из условия
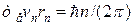 , ,
| (1.1) |
где те – масса электрона;
vп – его линейная скорость;
rп – радиус n-ой орбиты;
 – постоянная Планка;
– постоянная Планка;
n=1, 2, 3, ...
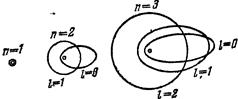
Рисунок 1.1. – Возможные орбиты электрона в атоме водорода
(для различных квантовых чисел). Большие полуоси эллипса относятся
как квадраты целых чисел 12; 22; 32; 42 и т. д.
Определенным стационарным орбитам электронов (точнее, стационарным состояниям атома) соответствуют определенные значения энергии (дискретные уровни энергии).
Атом излучает электромагнитную энергию, если электрон переходит с удаленной от ядра стационарной орбиты на ближнюю; при переходе электрона с ближней орбиты на дальнюю атом поглощает энергию. Величина излученного или поглощенного при переходах кванта энергии 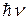 определяются условием
определяются условием
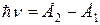
| (1.2) |
где 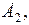
 – дискретные уровни энергии в атоме до и после перехода электрона.
– дискретные уровни энергии в атоме до и после перехода электрона.
По современным представлениям, электронных орбит не существует; имеется электронное распределение и рассчитывается лишь вероятность того, что электрон находится на определенном расстоянии от ядра. Однако и в современных теориях понятие о дискретных уровнях энергии атома остается в силе.
Состояние электрона в атоме (точнее, состояние атома в целом) определяется четырьмя квантовыми числами n, l, m, s:
главное квантовое число n может принимать значения 1, 2, 3, 4, ... и характеризует номер электронной оболочки, на которой находится электрон;
орбитальное квантовое число l указывает на форму орбитали и может иметь целочисленные значения от 0 до (n-1). Орбитали с l=0, 1, 2, 3 также называются s-, p-, d- и f-орбиталями;
магнитное квантовое число m, возможные варианты пространственной ориентировки орбитали характеризует принимающее целочисленные значения от -l до l, включая нуль;
спиновое квантовое число имеет единственное значение, равное ½.
Каждому электрону в атоме соответствует некоторый энергетический уровень, определяемый комбинацией значений трех квантовых чисел (n, l, m) и так называемой орбиталью. Понятием орбиталь в квантовой механике заменяется классическое представление об орбите электрона.
Спиновое квантовое число определяет собственный момент импульса Ms электрона (спина) и его возможные проекции Мsz,
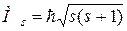 , , 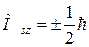
| (1.3) |
Принято говорить, что спин электрона (или другой частицы) равен одной второй (½), при этом подразумевается, что проекции собственного момента импульса равны 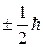 .
.
Четыре квантовых числа определяют энергетические электрона.
Состояния электронов входящих в состав одного и того же атома, отличаются друг от друга хотя бы одним значением квантового числа. Эта закономерность называется принципом Паули, которому подчиняются все частицы, имеющие полуцелый спин (фермионы).
При переходе электрона с одного энергетического уровня другой изменяются квантовые числа, определяющие его состояние. Как показывают теория и опыт, переход электрона возможен на такие уровни, когда изменение Dm=0, ±1, изменение Dl=±1.
В атоме совокупность электронов, которые имеют одинаковые квантовые числа п, образую слой или группу; совокупность электронов, имеющих одинаковые квантовые числа п и l образует оболочку(орбиталь). Слои значениям главного буквами К, L, M, N и т.д. (что соответствует значениям главного квантового числа п=1, 2, 3, 4, ...), оболочки обозначаются буквамиs, p, d, f и т.д. Наибольшее число электронов в слое равно 2п2. Заполнение оболочек у многоэлектронных атомов числа осуществляет в следующей последовательности 1s, 2s, 2p, 3s, 3р, 4s, 3d, 4р, 5s, 4d, 5р, 6s, 4f, 5d, 6p, 7s, 5f, 6d.
Химические свойства атомов определяются электронами его внешней оболочки. При переходах электронов во внешних оболочках излучаются световые и ультрафиолетовые электромагнитные волны.
Если из внутренней оболочки атома удалить электрон, то на эту оболочку будут самопроизвольно переходить электроны из других оболочек с большими номерами п. При таких переходах излучается характеристическое рентгеновское излучение с линейчатым спектром. Линии этого спектра соединяются в серии. Каждая серия определяется тем слоем, в который переходят электроны на вакантные места. Эти серия принято обозначать такими же буквами, какими обозначаются и слои: К, L, М, N,... Длины волн этих спектров определяются только дискретными уровнями энергии атомов данного вещества. Наиболее коротковолновое излучение соответствует К-серии.
Основные характеристики стабильных ядер – массовое число А, электрический заряд Ze, масса М, энергия связи DЕ, радиус R, спин I, магнитный момент m и другие величины.
Атомное ядро любого элемента состоит из протонов и нейтронов. Спин у нейтрона и протона, равен (1/2)  .
.
Атомы, имеющие одинаковый заряд ядер (и одинаковое число протонов), но отличающиеся друг от друга числом нейтронов, называются изотопами. Количество протонов и нейтронов, входящих в состав ядра, называется массовым числом(А).
Число нейтронов в ядре N=A–Z, где Z – атомный номер ядра, равный порядковому номеру атома в периодической системе. Заряд ядра равен Ze. Обе частицы – протон и нейтрон – называются нуклонами (ядерными частицами). Ядра, у которых число нейтронов одному из следующих чисел: 2, 8, 20, 28, 60, 82 и 120, называются магическими ядрами, а сами числа – магическими числами. Такие ядра имеют наибольшую стабильность.
Плотность ядра очень большая (порядка 1011 кг/см3), размер ядраимеет порядок 10-13 см (1 ферми).
Радиус ядра приближенно рассчитывается по формуле
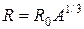 , ,
| (1.4) |
где А – массовое число, R0=(1,2–1,3)×10-13 см.
Спин ядра образуется из спинов нуклонов и их орбитальных моментов. Суммарный момент ядра, состоящий из четного числа протонов и четного числа нейтронов, равен нулю; момент ядра, которое состоит из нечетного числа нуклонов, определяет моментом непарного нуклона, т.е. i=s+l (s – спин непарного нуклона, l – орбитальный момент, выраженные в единицах  .
.
Нуклид – ядро любого элемента, которое имеет определенное строение и состав.
Нуклоны внутри ядра связаны особыми силами, которые называются ядерными силами. Ядерные силы в значительной мере зависят от расстояния между нуклонами; на расстоянии 1×10-13 см ядерные силы между нуклонами приблизительно в 135 раз больше сил электрического отталкивания и в 1038 раз больше гравитационного взаимодействия. На расстояниях меньше 0,7×10-13 см ядерные силы действуют как силы отталкивания, на расстояниях больше – 0,7×10-13 см–как силы притяжения, на расстоянии 2×10-13 см их действие равно нулю. Ядерные силы не зависят от электрического заряда и обладают свойством насыщения.
Ядерные силы имеют три составляющие: центральная сила, зависящая от расстояния, спин-спиновая сила и спин-орбитальная сила, которая возникает в результате искривления траектории одного нуклона при прохождении вблизи другого.
Энергия покоя частицы определяется соотношением 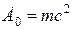 (т – масса покоя частицы, с – скорость света в вакууме). Ядро с массой М имеет энергию покоя
(т – масса покоя частицы, с – скорость света в вакууме). Ядро с массой М имеет энергию покоя 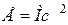 .
.
При образовании ядра ядерными силами производится работа, вследствие чего энергия покоя Е образовавшегося ядра будет меньше суммы покоя 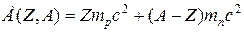 , где
, где  – масса покоя протона,
– масса покоя протона, 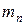 – масса покоя нейтрона. Величина
– масса покоя нейтрона. Величина
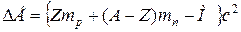 , ,
| (1.5) |
называется энергией связи ядра, а разность между массами невзаимодействующих нуклонов и массой образовавшегося из них ядра называется дефектом масс DМ:
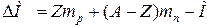 . .
| (1.6) |
1.2. Явление радиоактивности
Радиоактивность – это свойство ядер некоторых элементов самопроизвольно превращаться с изменением состава и энергетического состояния. Радиоактивность является внутренним свойством ядер, не зависит от внешних условий их существования и связана с соотношением ядерных сил.
Ядро состоит из положительно заряженных протонов, количество которых определяет заряд ядра и порядковый номер элемента в периодической системе, и электрически нейтральных нейтронов; сумма протонов и нейтронов (нуклонов) равна атомному весу элемента. Силы, удерживающие нуклоны в ядре, называются ядерными силами. Они носят обменный характер, т. е. между протонами и нейтронами в ядре происходит постоянный обмен p-мезоном.
Основным свойством ядерных сил, влияющим на радиоактивность, является их короткодействие. В ядре каждый нуклон ядерными силами связан не со всеми нуклонами, а только с близлежащими. Радиус действия ядерных сил порядка 10-15 м. Ядро такого размера, в котором ядерные силы достигают насыщения, наиболее устойчиво. Это ядро гелия с двумя протонами и двумя нейтронами или a-частица, если это ядро имеет кинетическую энергию. Ядра других элементов, которые могут быть составлены из ядер гелия, обладают также максимальной устойчивостью и наибольшей распространенностью в горных породах. Это ядра элементов кислорода (8 протонов и 8 нейтронов), кремния (14, 14), кальция (20, 20). Напротив, ядро бериллия, состоящее из 5 нейтронов и 4 протонов (2 a-частицы+нейтрон), аномально неустойчиво, распадается при облучении гамма-квантами относительно небольшой энергии.
Энергия связи нуклонов в ядре может быть легко рассчитана
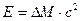 , ,
| (1.7) |
где DM – дефект массы; с – скорость света в вакууме. Расчеты показывают: чем сложнее ядро, чем больше в нем протонов и нейтронов, тем меньше энергия связи в расчете на нуклон. Поэтому радиоактивность – это свойство преимущественно тяжелых элементов. Все элементы, порядковый номер которых больше 81 (таллий), являются радиоактивными или содержат радиоактивные изотопы.
В горных породах наблюдаются в основном четыре вида радиоактивных превращений: альфа-распад, бета-распад, электронный захват и деление ядер.
Альфа-превращение заключается в испускании ядром a-частицы. a-частица представляет собой положительно заряженное ядро атома гелия с зарядом, равным двум, и массовым числом 4. При альфа-распаде масса излучающего ядра уменьшается на 4 единицы, заряд – на две, а также испускаются два электрона с наружных оболочек атома.
Энергетический спектр a-частиц, испускаемых определенным радиоактивным изотопом, линейчатый. Но для одного и того же a-излучателя может наблюдаться несколько энергетических групп a-частиц.
Путь a-частицы в веществе прямолинеен. Длина пути, проходимого частицей до полной потери энергии, называется пробегом. Пробег a-частицы в воздухе при нормальных условиях не превышает 10 см.
Примером альфа-превращения в горных породах может служить превращение радия в радиоактивный газ радон:
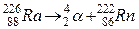 .
.
Бета-превращение состоит в испускании ядром b-частицы электрона (b-илие-) или позитрона (b+илие+) при преобразовании в ядре нейтрона в протон (n®p+e-) и наоборот (p® n +e+). Бета-распад сопровождается испусканием нейтральной частицы с нулевой массой – нейтрино n.
88 % ядер радиоактивного изотопа 40К испытывает этот тип превращения:
 .
.
Еще один пример – превращение
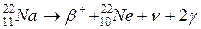 .
.
При бета-распаде энергия распределяется между тремя частицами: позитроном или электроном, нейтрино и ядром. Поэтому позитроны и электроны при бета-распаде обладают в отличие от альфа-частиц сплошным спектром энергий. Величина максимальной энергии бета-частиц у отдельных изотопов может достигать 5 МэВ. Максимальный пробег, характеризующийся толщиной слоя вещества, который может пройти бета-частица практически до полного погашения ее энергии, меняется примерно от 0,001 г/см2до 1,6 г/см2.
Электронный захват заключается в захвате ядром электрона с внутреннего k-слоя и превращении протона в нейтрон, энергия реакции выносится нейтрино и в некоторых случаях также гамма-излучением. В 12 % случаев ядро 40К испытывает этот тип превращения:
 .
.
Образовавшиеся в ходе радиоактивного превращения ядра чаще всего оказываются в возбужденном состоянии. Переходя в нормальное состояние, они излучают избыток энергии в виде гамма-квантов.
Деление ядер. При этом процессе ядра некоторых тяжелых элементов (  ,
, 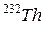 )самопроизвольно или под действием нейтронов и других частиц делятся на две части, обычно с неодинаковой массой. При самопроизвольном делении, помимо осколков деления, излучаются два-три нейтрона, а иногда и другие частицы. Вновь образовавшиеся ядра обычно нестабильны и распадаются путем испускания нескольких нейтронов и b--частиц.
)самопроизвольно или под действием нейтронов и других частиц делятся на две части, обычно с неодинаковой массой. При самопроизвольном делении, помимо осколков деления, излучаются два-три нейтрона, а иногда и другие частицы. Вновь образовавшиеся ядра обычно нестабильны и распадаются путем испускания нескольких нейтронов и b--частиц.
Гамма-излучение. Переход ядер с более высоких энергетических уровней на более низкие сопровождается испусканием гамма-квантов. Гамма-излучение сопровождает изомерные превращения большинства ядер при переходе их из возбужденного состояния в основное.
В сравнении с другими видами электромагнитного излучения гамма-излучение характеризуется большей энергией и большей частотой колебаний. Последнее вытекает из соотношения
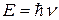 , ,
| (1.7) |
где  – постоянная Планка;
– постоянная Планка;
n – частота.
Для гамма-излучения более характерны корпускулярные, нежели волновые, свойства. Гамма-излучение можно представлять как поток частиц массы 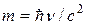 , распространяющихся со скоростью света. Благодаря значительно более высокой проникающей способности g-лучей в сравнении с a- и b-частицами в методах разведочной геофизики используется в основном g-излучение.
, распространяющихся со скоростью света. Благодаря значительно более высокой проникающей способности g-лучей в сравнении с a- и b-частицами в методах разведочной геофизики используется в основном g-излучение.
Энергия g-излучения индивидуальна для каждого вида ядер и является параметром конкретного ядерного превращения. Так, при превращении радия в радон испускается гамма-квант энергии 0,19 МэВ, поскольку именно такая разница между энергиями возбужденного и нормального состояний имеет место у радона.
Энергия g-квантов естественных радиоактивных изотопов изменяется от 0,01 до 2,6 МэВ.
Поскольку в радиоактивных рядах много излучателей, горная порода характеризуется сложным спектром гамма-излучения. Большинство гамма-квантов имеет низкую (<1 МэВ) энергию, что затрудняет идентификацию по ним элементов. На рис. 1.2 приведена жесткая часть спектра гранитов. Наиболее выразительны пики энергий 1,76 и 2,2 МэВ, соответствующие элементам уранового ряда, а так же энергий 0,92 и 2,62, отвечающие элементам ториевого ряда. Энергия 1,45 МэВ принадлежит калию. По величине пиков названных энергий можно раздельно определить содержание урана, тория и калия.
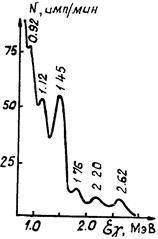
Рисунок 1.2 – Жесткая часть спектра гамма-излучения гранитов
Время распада отдельно взятого ядра предсказать невозможно, так как радиоактивное превращение – явление случайное. Закономерность проявляется для большого числа атомов. Она выражена законом радиоактивного превращения, заключающимся в том, что количество превращающихся ядер пропорционально имеющемуся количеству радиоактивных ядер. Коэффициент этой пропорциональности есть параметр распадающегося атома l постоянная распада, которая имеет смысл вероятности распада за единицу времени.
В дифференциальном виде эта зависимость выражается следующим образом:
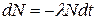 , ,
| (1.8) |
где dN – число распадающихся атомов из общего количества N за время dt,
l – постоянная распада.
После интегрирования формула (1.8) отражает экспоненциальный закон изменения количества радиоактивных атомов во времени:
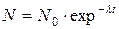 , ,
| (1.9) |
где t – время с начала превращения;
N0, N – количество атомов превращающеюся элемента соответственно в момент времени 0 и t.
Более удобным для использования параметром распадающегося ядра является период полураспада Т1/2, зависящий только от l:
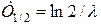 . .
| (1.9) |
Период полураспада равен времени, за которое превращается половина атомов. Приближенно через 10T1/2, распадутся все атомы.
Приведем периоды полураспада наиболее распространенных радиоактивных изотопов горных пород (табл. 1.1.).
Таблица 1.1
| Изотоп | Содержание в земной коре, % | Период полураспада, лет |
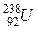
| 2,6*10-4 | 4,49*109 |

| 11,3*10-4 | 1,4*1010 |
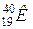
| 3*10-4 | 1,47*109 (b); 1,24*1010 |
Отметим, во-первых, низкое содержание радиоактивных элементов в земной коре. Сравним, например, с распространенностью таких породообразующих элементов, как Si (27,7%) или Са (3,63%). Содержание других радиоактивных элементов еще ниже. Во вторых, у урана, тория и калия очень большой период полураспада, т. е. они относительно слаборадиоактивные элементы. Например, радий распадается в миллионы раз быстрее, чем уран, а радон – в миллиарды раз. Но во столько же раз этих элементов меньше в земной коре в сравнении с ураном. В этом проявляется зависимость распространенности элемента в природе от стабильности его ядра.
Если при превращении ядра 40К образуются сразу стабильные изотопы Са и Аr, то при распаде ядер урана и тория вновь образованные изотопы также являются радиоактивными. Вслед за распадом U и Th тянутся целые цепочки радиоактивных превращений, заканчивающиеся образованием стабильных изотопов свинца (см. рис 1.2). Изотопы элементов, участвующие в этих последовательных превращениях, образуют так называемые радиоактивные ряды, родоначальниками которых является уран и торий. Так, радий и радон входят в состав уранового ряда.
Главной особенностью радиоактивных рядов является та, что наиболее долгоживущим (наименее радиоактивным) элементом ряда является его родоначальник, т. е. уран или торий. Все остальные элементы ряда распадаются быстро. Это обстоятельство, а также экспоненциальный характер закона радиоактивного превращения приводят к важному свойству радиоактивных рядов – радиоактивному равновесию. Оно проявляется в неизменности количеств элементов середины ряда, поскольку число распадающихся и образующихся атомов уравновешено.
Количества атомов радиоактивных элементов ряда взаимосвязаны между собой и с количеством атомов родоначальника, т. е. урана или тория:
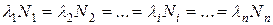 . .
| (1.10) |
где li – постоянная распада i-го элемента ряда;
Ni – количество атомов этого элемента.
Согласно соотношению (1.10), зная количество атомов одного элемента ряда, можно определить количество всех остальных.
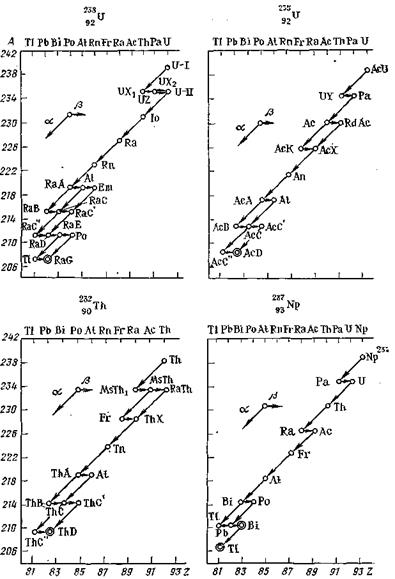
Рисунок 1.2 – Радиоактивные семейства
Дата добавления: 2021-05-28; просмотров: 383;











