ГЛУБИННОЕ КУЛЬТИВИРОВАНИЕ
По сравнению с рассмотренным нами ранее поверхностным способом культивирования микроорганизмов глубинный способ культивирования имеет ряд существенных преимуществ: при его использовании возможно менять состав питательной среды в широком интервале значений концентраций различных компонентов, добиваясь при этом максимального выхода целевого продукта с единицы объема ферментационного оборудования, в технологическом процессе значительно сокращается доля ручного труда (транспортировка питательной среды, загрузка и разгрузка аппарата) он требует меньших затрат на организацию процесса автоматизации различных стадий, предлагает более простую последующую переработку биомассы микроорганизмов с целью выделения и очистки готового продукта.
Рассмотрим принципиальную технологическую схему глубинного культивирования микроорганизмов на рис.1.
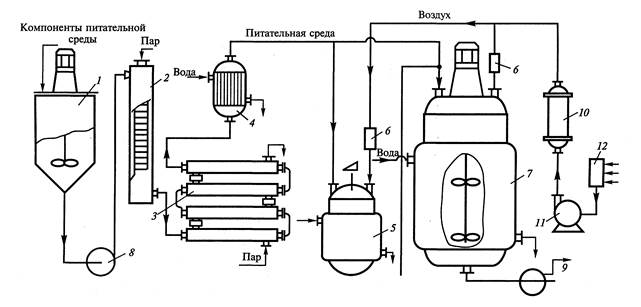
Рис.1 Принципиальная технологическая схема глубинного культивирования микроорганизмов.
1 - смеситель питательной среды; 2 - колонка для непрерывной стерили зации потока питательной среды; 3 - теплообменник - выдерживатель; 4 - теплообменник для охлаждения потока питательной среды; 5 - инокуляторы (или посевные аппараты); 6 - индивидуальный фильтр для очистки воздуха; 7 - ферментер; 8,9 - насосы; масляный фильтр для предварительной очистки воздуха; 11 - компрессор; 12 - головной фильтр для очистки воздуха.
Для любого биотехнологического процесса существует множество вариантов организации производства на промышленном уровне. Однако все процессы можно разделить на две большие группы - периодические и непрерывные.
При периодическом способе производства простерилизованный ферментер заполняется питательной средой, часто уже содержащей нужные микроорганизмы. Биохимические процессы в этом ферментере продолжаются от нескольких часов до нескольких дней. При этом типе культивирования клеточная культура может пройти все фазы своего развития:
1) Lag-фазу, или фазу задержанного роста, при которой клетки растут медленно и адаптируются к новой среде обитания в объеме ферментера;
2) фазу ускорения – когда адаптация закончилась и клетки начинают интенсивно делиться
3) Log-фазу, характеризующаяся интенсивным делением клеток и сбалансированностью роста всей популяции;
4) фазу замедленного роста, связанную с исчерпанием питательных субстратов и накоплением токсических продуктов метаболизма;
5) Const- фазу или стационарную фазу, при которой прирост новых клеток количественно равняется числу погибающих;
6) фазу отмирания, характеризующуюся прогрессирующей гибелью клеток.
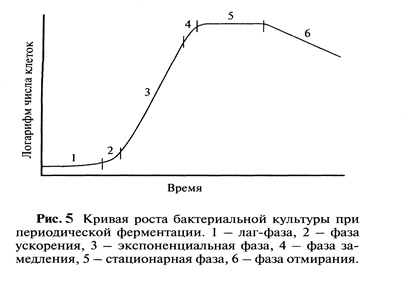
Синтез первичных метаболитов наиболее интенсивно идет с середины Log-фазы до середины стационарной. Ближе к концу стационарной фазы может начаться синтез вторичных метаболитов.
Периодически ферментер опорожняют, моют, стерилизуют, целевой продукт отправляют на очистку, и начинают новый цикл.
Системы, функционирующие в таких условиях, характеризуются как batch-системы(замкнутые системы). Большинство современных биотехнологических систем функционируют как batch-процессы, при которых однажды оптимизированные условия обеспечивают максимальное накопление целевого (требуемого) продукта.
При непрерывном способе подача равных объемов сырья (питательных веществ) и отвод культуральной жидкости, содержащей клетки продуцента и целевой продукт осуществляется одновременно. Такие ферментационные системы характеризуются как открытые. Через некоторое время после начала процесса в таком ферментере устанавливается динамическое равновесие между процессами размножения клеток с одной стороны и процессами отмирания и вымывания живых клеток их аппарата с другой. В результате концентрация клеток устанавливается на определенном уровне, задаваемом технологическим режимом (скоростью протока, количеством питательных веществ, температурой). Теоретически такая сonst-фаза, при неизменных параметрах процесса культивирования может поддерживаться бесконечно долго. Ферментер, работающий в таком режиме, значительно более прост в управлении, по сравнению с аналогичным, работающим в периодическом режиме. Это обусловлено тем, что при постоянстве концентрации клеток продуцента постоянными являются и все их потребности (питательные вещества, воздух) и параметры процесса (тепловыделение, уровень рН, выделение целевого продукта).
Принцип непрерывного проточного культивирования похож на непрерывные процессы в химической технологии и подобно им может реализовываться по двум основным схемам:
1. процесс идеального (полного) вытеснения;
2. процесс идеального (полного) смешения;
Реактор для выращивания микроорганизмов в процессе полного вытеснения в общем виде представляет собой трубу, расположенную вертикально или горизонтально. При этом в один конец медленно втекает среда и посевной материал (микроорганизмы), а из другого конца вытекает культуральная жидкость. При этом из-за примерно одинаковой скорости движения и отсутствия завихрений перемешивания слоев жидкости в реакторе не происходит (ламинарный режим). Уменьшение концентрации питательных веществ и накопление продуктов биосинтеза, а так - же клеточной биомассы происходит в таком реакторе не только во времени, но и в пространстве (от начала реактора к концу). В таком режиме обычно проводят анаэробное культивирование. Процесс полного вытеснения применяется в крупнотоннажных производствах в тех случаях, когда желательно избежать потери времени на опорожнение, стерилизацию и заполнение емкости (производство пива).
В процессе полного смешения рост культур микроорганизмов происходит в реакторе-ферментере при интенсивном перемешивании культуральной среды с помощью мешалок (турбулентный режим). При этом в любой точке ферментера все параметры среды должны быть примерно одинаковы. Изменение всех параметров культивирования происходит только во времени. Этот метод культивирования, называемый еще гомогенно-непрерывным, наиболее широко применяется в аэробных процессах, как периодических, так и непрерывных.
Выбор между периодическим и непрерывными способами зависит прежде всего от экономических причин, а так же от специфичности условий производства тех или иных веществ. Непрерывные процессы, как правило, лучше приспособлены для крупномасштабного производства, из-за постоянства концентрации клеток в них легче поддерживать во времени параметры процесса (температуру, рН, уровень аэрирования), однако до настоящего времени большая часть микробиологических продуктов производится периодическим способом. Причинами этого в основном являются малотоннажность и широкий ассортимент производимых продуктов, а также особенности культивирования тех или иных их продуцентов, что не позволяет унифицировать как ферментеры, так и их технологическую оснастку. Все это вместе часто делает экономически невыгодным внедрение непрерывных технологий. Однако в таких областях, как крупномасштабное производство растворителей, промышленных ферментов, кормового белка и кормовых добавок (аминокислот, витаминов и др.), биологической очистке сточных вод, непрерывные способы прочно заняли главенствующее положение.
В последнее время все чаще начинают использовать методы, занимающие промежуточное положение между непрерывным и периодическим культивированием (полунепрерывное культивирование):
1.периодическое культивирование с подпиткой, при котором, помимо первичного внесения питательного субстрата до засева культуры, в процессе культивирования в аппарат через определенные интервалы добавляют небольшие объемы питательных веществ либо порциями, либо непрерывно «по каплям».
Полунепрерывный отъемно-доливной метод, когда в течении всего процесса периодического культивирования часть одержимого биореактора периодически изымается и добавляется равное количество свежей питательной среды. Такой прием обеспечивает регулярное «омолаживание» (обновление) культуры и в 2-3 раза задерживает (отдаляет) ее переход в фазу отмирания. Недостаток состоит в том, что доливы осуществляют питательной средой полного состава, что неприемлемо для синтеза вторичных метаболитов.
Этого недостатка лишен метод полунепрерывной регулируемой ферментации. Суть этого метода состоит в том, что в определен время, начиная с логарифмической фазы размножения, по специально разработанной программе, в культуральную жидкость, добавляют отдельные компоненты питательной среды (сначала раствор сахаров, потом аммония сульфат и другие микроэлементы, а так же те или иные вещества предшественники), поддерживая их концентрацию на постоянном благоприятном уровне - вначале для роста массы клеток, а затем - для синтеза целевого продукта (вторичного метаболита). Периодически из ферментатора отбирают пробы культуральной жидкости и определяют концентрацию сначала клеток, а потом и целевого продукта. Ферментацию прекращают после того как она достигает максимума. Этим способом удается не только продлить активную фазу, в которой находится продуцент, но и повысить степень использования им субстрата, а в конечном итоге - продуктивность процесса, то есть увеличить выход конечного продукта в расчете на потребленный субстрат.
4. Если целевой продукт является эндометаболитом, т.е. находится внутри клетки, то для получения более плотной клеточной культуры проводят периодическое культивирование в режиме диализа.При этом питательный субстрат постоянно поступает в реактор через специальную мембрану и через нее же отводится часть культуральной жидкости без клеток. Диализ ведет к снижению концентрации продуктов жизнедеятельности клеток, неблагоприятно влияющих на их жизнеспособность. Этот метод не нужно путать с непрерывным проточным культивированием.
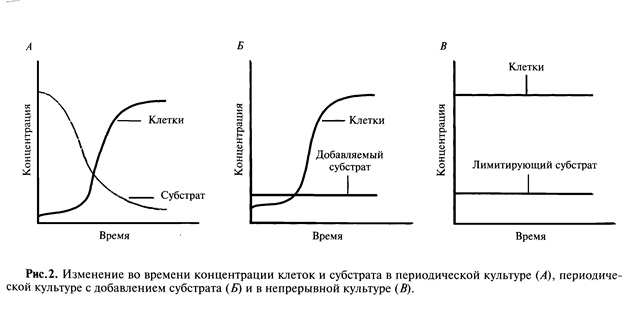
Метод проточного непрерывного культивирования пришел в микробиологию из химической технологии. Принцип проточного культивирования состоит в том, что в сосуд, где размножаются микроорганизмы, непрерывно подается свежая питательная среда и одновременно вытекает такой же объем культуральной жидкости, содержащей клетки и продукты их жизнедеятельности. Основным принципом непрерывных процессов (как уже отмечалось выше) является точное соблюдение равновесия между приростом биомассы вследствие деления клеток и их убылью в результате разбавления содержимого свежей питательной средой.
В зависимости от того, на каком принципе основано поддержание постоянства концентрации клеток различают турбидостатический и хемостатическийрежимы непрерывного культивирования.
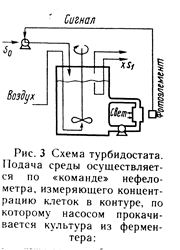
Притурбидостатическом режиме культивирования постояннство концентрации клеток обеспечивается управляемым изменением скорости протока жидкости через аппарат за счет подачи больших или меньших объемов питательной среды. Наиболее распространенным методом определения концентрации клеток в культуральной жидкости является измерение светорассеивания (мутности) выходящего из ферментера потока с помощью прибора-нефелометра, измеряющего мутность жидкости по величине светорассеяния. Сам прибор посредством электрической схемы связан с насосом для подачи питательной среды или вентилем (краном), регулирующим эту подачу. Повышение концентрации клеток в культуральной жидкости, приводит к увеличению светорассеяния, что автоматически вызывает увеличение объема подаваемой в аппарат свежей питательной среды, и что, в свою очередь, приводит к вымыванию избыточных клеток. Наоборот, при уменьшении светорассеяния (снижении концентрации клеток) скорость протока жидкости через аппарат уменьшается и соответственно уменьшается процесс их вымывания из ферментера.
Недостатком турбидостатического режима является то, что в этом режиме невозможно достигнуть полного усвоения питательных веществ и при выделении целевого продукта они могут безвозвратно теряться или загрязнять его, усложняя процесс очистки. При длительном культивировании в турбидостате возникает довольно серьезная проблема, связанная с прилипанием клеток к фотоэлементу и искажения его показаний. Однако имеются и определенные преимущества. Так, например, если засевается смешанная культура, то в турбидостате автоматически отбирается более быстро растущий вид, что может использоваться для предохранения его от заражения посторонней микрофлорой (если, конечно, она растет медленнее) и селекции определенных форм.
При хемостатическом режиме поддержание постоянства концентрации культуры продуцента осуществляется за счет регулирования не выходящего, а входящего потока. Сущность регулирования состоит в том, что концентрацию основного питательного вещества (или одного из основных), поступающего в реактор устанавливают на определенном уровне, который ограничивает (лимитирует) степень размножения микроорганизмов, поддерживая тем самым культуру микроорганизма в определенной нужной концентрации. Такой метод регулирования называетсяхемостатическим, а реактор - хемостатом.
Хемостаты применяются в процессах, характеризующихся малой скоростью протока жидкости и низкой концентрацией питательных веществ, что облегчает саморегулировку системы. Недостатком хемостатического метода регулирования является то, что в этом случае обычно не удается получить продукты в достаточно высокой концентрации и добиться полной утилизации питательных веществ.
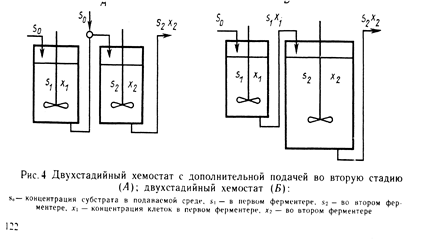
Особенно неэффективными являются такие реакторы при получении различных вторичных метаболитов, таких как антибиотики. Это связано с тем, что процесс получения вторичных метаболитов состоит из двух стадий, и оптимальные условия для той или другой стадии могу существенно различаться между собой. Одноступенчатый хемостат в лучшем случае может обеспечить только компромис между разными условиями, оптимальными для этих двух условий. Условия, более благоприятные для каждой стадии жизненного цикла можно создать при использовании двух- или более ступенчатого хемостата. Однако такой установкой весьма сложно управлять и она требует больших капиталовложений. В настоящее время одноступенчатый и многоступенчатые хемостаты нашли применение в основном в различных процессах утилизации отходов и очистки сточных вод.
Еще одним недостатком непрерывного метода является то, что в таких аппаратах невозможно или очень трудно и неудобно использовать неразмножающиеся клетки, споры или чистые ферменты. Вымываемые из ферментера клетки или ферменты практически невозможно регенерировать (отделить, промыть, вернуть в аппарат) без потери активности и с сохранением асептики. Аналогичные проблемы имеют место и при периодическом культивировании. Это является весьма невыгодным с экономической точки зрения, учитывая высокую стоимость чистых ферментных препаратов и штаммов микроорганизмов, а так же сложность подготовки и запуска процесса.
Эффективным способом решения этой проблемы является использование так называемых иммобилизованных биокатализаторов (клеток или ферментов). Процесс иммобилизации заключается в (закреплении) молекул фермента или целых живых клеток на (или в) специальных носителях или насадках значительно большего (на много порядков) размера. При этом биокатализатор из фактически гомогенного становится гетерогенным. Существует целый ряд методов иммобилизации, основанных на механическом, физико-химическом и химическом закреплении ферментов и клеток на носителях природного или искусственного происхождения. После окончания процесса такой катализатор легко отделить фильтрованием от культуральной жидкости, очистить, а иногда даже регенерировать. Такие катализаторы обычно имеют большой срок действия, по сравнению с неиммобилизованными, удобны в обращении, но имеют гораздо более высокую стоимость и требуют использования специально сконструированных для их использования ферментеров, что препятствует их широкому использованию. (Более подробно об иммобилизованных биокатализаторах и специальных конструкциях ферментеров см. методичку “Инженерная энзимология”.
Дата добавления: 2017-01-26; просмотров: 3980;











