Гормоны поджелудочной железы.
Обратите внимание, что эндокринная часть поджелудочной железы продуцирует и выделяет в кровь гормоны инсулин и глюкагон.
1. Инсулин. Инсулин – белково-пептидный гормон, вырабатываемый β-клетками островков Лангерганса. Молекула инсулина состоит из двух полипептидных цепей (А и В), содержащих 21 и 30 аминокислотных остатков соответственно; цепи инсулина связаны между собой двумя дисульфидными мостиками. Образуется инсулин из белка-предшественника (препроинсулина) путём частичного протеолиза (см. рисунок 4). После отщепления сигнальной последовательности образуется проинсулин. В результате ферментативного превращения удаляется фрагмент полипептидной цепи, содержащий около 30 аминокислотных остатков (С-пептид), и образуется инсулин.
Стимулом для секреции инсулина является гипергликемия – повышение содержания глюкозы в крови (например, после приёма пищи). Главные мишени для инсулина – клетки печени, мышц и жировой ткани. Механизм действия – дистантный.
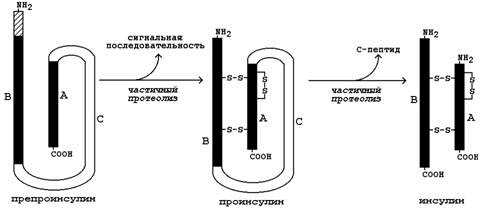
Рисунок 4. Схема превращения препроинсулина в инсулин.
Рецептор инсулина представляет собой сложный белок – гликопротеин, расположенный на поверхности клетки-мишени. Этот белок состоит их двух α-субъединиц и двух β-субъединиц, связанных между собой дисульфидными мостиками. β-Субъединицы содержат несколько аминокислотных остатков тирозина. Рецептор инсулина обладает тирозинкиназной активностью, т.е. способен катализировать перенос остатков фосфорной кислоты от АТФ на ОН-группу тирозина (рисунок 5).
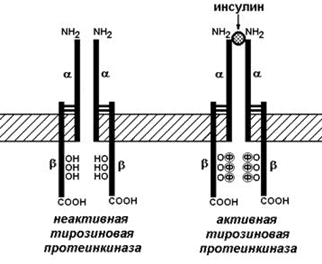
Рисунок 5. Инсулиновый рецептор.
В отсутствие инсулина рецептор не проявляет ферментативной активности. При связывании с инсулином рецептор подвергается аутофосфорилированию, т.е. β-субъединицы фосфорилируют друг друга. В результате изменяется конформация рецептора и он приобретает способность фосфорилировать другие внутриклеточные белки. В дальнейшем комплекс инсулина с рецептором погружается в цитоплазму и его компоненты расщепляются в лизосомах.
Образование гормон-рецепторного комплекса повышает проницаемость клеточных мембран для глюкозы и аминокислот. Под действием инсулина в клетках-мишенях:
а) снижается активность аденилатциклазы и увеличивается активность фосфодиэстеразы, что приводит к понижению концентрации цАМФ;
б) повышается скорость окисления глюкозы и снижается скорость глюконеогенеза;
в) увеличивается синтез гликогена и жиров и подавляется их мобилизация;
г) ускоряется синтез белка и тормозится его распад.
Все эти изменения направлены на ускоренное использование глюкозы, что приводит к снижению содержания глюкозы в крови. Инактивация инсулина происходит главным образом в печени и заключается в разрыве дисульфидных связей между цепями А и В.
2. Глюкагон. Глюкагон – полипептид, содержащий 29 аминокислотных остатков. Он продуцируется α-клетками островков Лангерганса в виде белка-предшественнника (проглюкагона). Частичный протеолиз прогормона и секреция глюкагона в кровь происходит при гипогликемии, вызванной голоданием.
Клетки-мишени для глюкагона – печень, жировая ткань, миокард. Механизм действия – дистантный (посредником является цАМФ).
Под действием глюкагона в клетках-мишенях:
а) ускоряется мобилизация гликогена в печени (см. рисунок 6) и тормозится его синтез;
б) ускоряется мобилизация жиров (липолиз) в жировой ткани и тормозится их синтез;
в) угнетается синтез белка и усиливается его катаболизм;
г) ускоряется глюконеогенез и кетогенез в печени.
Конечный эффект глюкагона – поддержание высокого уровня глюкозы в крови.
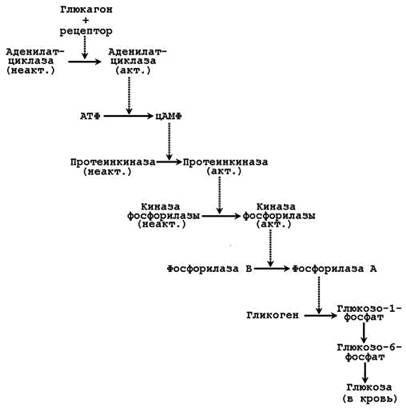
Рисунок 6. Каскадный механизм активации фосфорилазы гликогена под влиянием глюкагона.
3. Нарушения гормональной функции поджелудочной железы. Наиболее часто встречается сахарный диабет – заболевание, обусловленное нарушением синтеза и секреции инсулина β-клетками (диабет I типа) либо дефицитом инсулинчувствительных рецепторов в клетках-мишенях (диабет II типа). Для сахарного диабета характерны следующие нарушения обмена веществ:
а) снижение использования глюкозы клетками, усиление мобилизации гликогена и активация глюконеогенеза в печени приводят к увеличению содержания глюкозы в крови (гипергликемия) и преодоление ею почечного порога (глюкозурия);
б) ускорение липолиза (расщепления жиров), избыточное образование ацетил-КоА, используемого для синтеза с последующим поступлением в кровь холестерола (гиперхолестеролемия) и кетоновых тел (гиперкетонемия); кетоновые тела легко проникают в мочу (кетонурия);
в) снижение скорости синтеза белка и усиление катаболизма аминокислот в тканях приводит к повышению концентрации мочевины и других азотистых веществ в крови (азотемия) и увеличению их выведения с мочой (азотурия);
г) выведение почками больших количеств глюкозы, кетоновых тел и мочевины сопровождается увеличением диуреза (полиурия).
Дата добавления: 2017-01-08; просмотров: 1985;











