Свойства теплоизолированных процессов. Первое начало термодинамики.
Из опыта следует, что:
1. Между двумя состояниями системы возможен хотя бы один теплоизолированный переход.
2. В адиабатически изолированной системе работа не зависит от пути переходе, а только от начального и конечного состояний системы.
Эти формулировки представляют собой практически закон сохранения энергии для изолированных процессов и позволяет ввести функции состояния: внутреннюю энергию U (переход 1à2, работа системы A12 = U1-U2, работа над системой A*12 = U1-U2). Действительно, т.к. 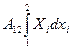 , где Xi – функция состояния не зависит от пути, и, естественно, dA = Xidxi – есть полный дифференциал некоторой функции. Вот ее то мы и обозначим –dU: dA = -dA. Величина U не включает в себя потенциальную и кинетическую энергию системы как целого. Вообще говоря полная энергия Uполн = Uкин + Uпот + U. В дальнейшем будем полагать, как это обычно делается в термодинамике, Uкин = Uпот = 0. Есть однако еще один способ изменения внутренней энергии. Если работа над системой (или системой) не совершается, то U2 – U1 = Q*12, где Q*12 - количество тепла получаемое системой при переходе 1à2. Отметим, что Q*12 от пути перехода зависит и никаким полным дифференциалом не является.
, где Xi – функция состояния не зависит от пути, и, естественно, dA = Xidxi – есть полный дифференциал некоторой функции. Вот ее то мы и обозначим –dU: dA = -dA. Величина U не включает в себя потенциальную и кинетическую энергию системы как целого. Вообще говоря полная энергия Uполн = Uкин + Uпот + U. В дальнейшем будем полагать, как это обычно делается в термодинамике, Uкин = Uпот = 0. Есть однако еще один способ изменения внутренней энергии. Если работа над системой (или системой) не совершается, то U2 – U1 = Q*12, где Q*12 - количество тепла получаемое системой при переходе 1à2. Отметим, что Q*12 от пути перехода зависит и никаким полным дифференциалом не является.
В общем случае для малых приращений можно написать:
dU = đQ* + dA* или đQ* = dU + dA (I)
Эти формулы представляют собой математическую формулировку первого принципа (начала) термодинамики.
 В этих формулах dU – полный дифференциал, но не dA и dQ*!!! Физически это ни что иное, как закон сохранения энергии в применении к задачам термодинамики.
В этих формулах dU – полный дифференциал, но не dA и dQ*!!! Физически это ни что иное, как закон сохранения энергии в применении к задачам термодинамики.
Примечание: Энергия – аддитивная функция состояния, т.е. полная энергия систем I и II равна сумме энергий: UI + UII =U. Это следует из I-го начала: интеграл между состояниями 1 и 2 аддитивен с точность до энергии взаимодействия:
Uвз << UI,UII
Дата добавления: 2021-05-28; просмотров: 186;











