Основы строения материалов
Структура вещества в твердом состоянии
В твердом состоянии большинство неорганических материалов (более 96 %) имеют кристаллическое строение, т. е. правильное, упорядоченное, периодическое расположение атомов, ионов или молекул в пространстве.
Характер расположения атомов, ионов или молекул в пространстве принято описывать с помощью кристаллической решетки. Если мысленно соединить центры тяжести атомов, ионов или молекул прямыми, то образуется пространственная решетка, в узлах которой находятся те частицы, из которых состоит вещество. Так как положение атомов в пространстве является периодическим, правильным, а следовательно, симметричным, то и кристаллическая решетка также будет обладать определенной симметрией.
Симметрией кристаллов называют их свойство совмещаться с собой при поворотах, отражениях, параллельных переносах или при комбинации этих операций.
На рис. 3.1 показаны пример правильного, периодического расположения атомов в пространстве и кристаллическая решетка.
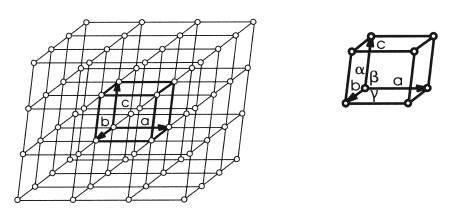
Рис. 3.1. Схема расположения атомов в твердом теле.
В кристаллической решетке можно выделить минимальный объем, с помощью которого описываются положение атомов и симметрия решетки в целом. Этот параллелепипед называется элементарной ячейкой.
Таблица 3.1 Варианты кристаллических решеток
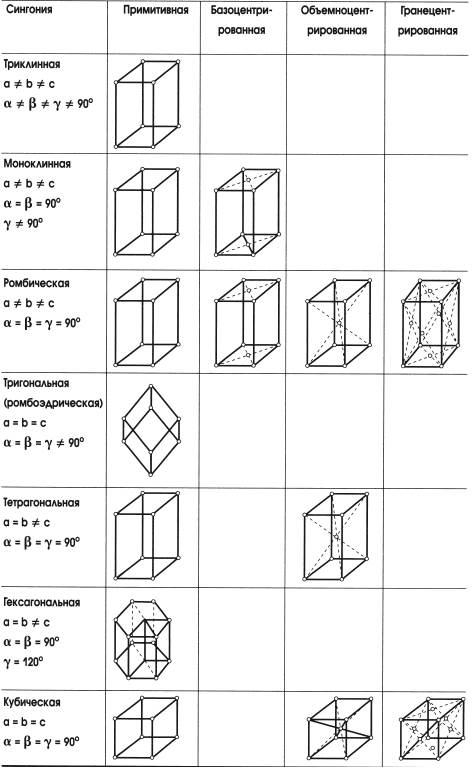
Ребро такого параллелепипеда называется периодом или параметром решетки. Величина параметра решетки соизмерима с размерами атома. Для металлов параметры решетки составляют 0,2–0,6 нм, в зависимости от размера атома и типа кристаллической решетки. Элементарные ячейки могут иметь прямые или косые углы, ребра параллелепипедов могут быть равны друг другу или не равны, а следовательно, у них разная симметрия.
По симметрии формы элементарные ячейки, и соответственно кристаллические решетки, разделены на три категории: низшую, среднюю и высшую. Низшая категория содержит три сингонии: триклинную, моноклинную и ромбическую. Средняя – также три сингонии: тригональную, тетрагональную и гексагональную. Высшая категория включает одну сингонию – кубическую (табл. 3.1).
Свойства вещества зависят от природы тех частиц, из которых оно состоит, типа связи и ее энергии, а также от типа кристаллической решетки. Так, например, углерод в твердом состоянии существует в двух кристаллических формах: в виде графита с гексагональной решеткой и в виде алмаза с кубической решеткой. Возможность существования одного и того же вещества в нескольких кристаллических формах называется аллотропией или полиморфизмом. Этим свойством обладают некоторые металлы (олово, железо, титан, марганец и др.).
Любое вещество в природе может существовать в трех агрегатных состояниях: газообразном, жидком и твердом. В подавляющем большинстве случаев в твердую фазу вещество переходит из жидкой.
Процесс перехода вещества из жидкого состояния в твердое называется кристаллизацией. В расплавленном, жидком состоянии металл не имеет правильного кристаллического строения. Однако расположение атомов не полностью хаотично. В жидкости имеются группы атомов с правильным расположением, характерным для кристаллической решетки данного вещества. Группы эти нестабильны изза большой подвижности атомов. Они образуются, рассыпаются, распадаются, возникают в новых местах. Такие группы атомов служат зародышами кристаллов в процессе кристаллизации, происходит при температуре ниже температуры плавления. Эта температура является константой для каждого вещества. Так, например, температура плавления меди составляет 1083 °C, серебра – 960 °C и т. д. При температурах ниже указанных эти металлы пребывают в твердом состоянии.
Процесс кристаллизации начинается с зарождения мелких кристалликов – зародышей кристаллизации. Их образование носит случайный характер. Другими словами, возникновение кристалла может произойти в любой части объема жидкости. Одновременно формируется не один, а несколько кристаллов (в некоторых случаях множество). Скорость зарождения – это число кристалликов, появляющихся в единице объема в единицу времени.
Образованные кристаллики растут за счет присоединения атомов из жидкости. При этом грань растущего кристалла перемещается в сторону жидкой фазы. Линейная скорость перемещения грани растущего кристалла называется скоростью роста кристалла.
На рис. 3.2 приведен пример кристаллизации в схематическом виде. Скорость зарождения составляет 4 зародыша в секунду, скорость роста кристалла – 1 мм в секунду. За первую секунду в объеме образовалось 4 кристаллика (обозначены цифрой 1). За вторую еще 4 (обозначены цифрой 2), а ранее возникшие кристаллы выросли на 1 мм с каждой стороны. В следующую секунду образовалось еще 4 кристалла (обозначены цифрой 3), и выросли все, образованные ранее, и т. д.
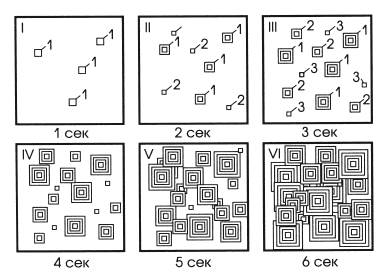
Рис. 3.2. Кинетика процесса кристаллизации.
Дата добавления: 2017-01-08; просмотров: 2095;











