СУПРЕССИЯ ИММУННОГО ОТВЕТА
ТОРМОЖЕНИЕ ИММУННОЙ СИСТЕМЫ
Для нормальной жизнедеятельности организма процессы торможения в иммунной системе так же необходимы, как и процессы её активации. Поясним на нескольких примерах: после уничтожения и выведения патогена из организма иммунный ответ естественным образом останавливается - развивается супрессия иммунного ответа,а иммунный ответ на собственные ткани организма предотвращает иммунная толерантность.Наконец, чрезвычайно важно торможение иммунной системы и при таких антропогенных вмешательствах, кактрансплантацияорганов и тканей. Ключевые роли в торможении иммунной системы принадлежат двум механизмам: ингибирующим межклеточным взаимодействиям и апоптозу.
АПОПТОЗ
Апоптоз (от греч. apoptosis - листопад) - программированная (регулируемая) гибель клеток путём деградации её компонентов, включая конденсацию хроматина и фрагментацию ДНК, с последующим фагоцитозом макрофагами. Необходимые для апоптоза гены («программа смерти») есть в каждой клетке, но их транскрипция начинается только при получении клеткой сигнала к апоптозу.
• Апоптоз в иммунной системе
- В иммунной системе апоптоз развивается при удалении аутореактивных клонов иммунокомпетентных клеток, регуляции численности пролиферирующих клеточных популяций, повреждении генома клеток.
- Аномально повышенная устойчивость (резистентность) клеток к апоптозу играет важную роль в патогенезе аутоиммунных нарушений и злокачественных новообразований за счёт подавления процесса гибели дефектных и мутантных клеток: например, при аутоиммунном лимфопролиферативном синдроме угнетён
апоптоз лимфоцитов, что вызвано мутацией гена, кодирующего «рецептор смерти» - гликопротеин Fas.
- Аномально повышенная гибель клеток путём апоптоза сопровождает острые (инфекционные заболевания, ишемические повреждения), а также ряд хронических патологий (нейродегенеративные заболевания, синдром приобретённого иммунодефицита).
- В иммунной системе известны рецепторы, связывание которых с лигандами индуцирует апоптоз в клетке-носителе рецептора.
◊ Рецепторы DR(от Death Receptor), относящиеся к семейству рецепторов фактора некроза опухоли (TNFR). Известно 5 разновидностей молекул группы DR. Их лигандами являются мембранные или растворимые молекулы семейства фактора некроза опухоли:
- Fas(CD95, DR1), лиганд которого - FasL - экспрессирован на ДК тимуса и индуцирует апоптоз тимоцитов при негативной селекции. Тот же лиганд присутствует на мембране ЦТЛ и естественных киллеров и вызывает гибель клеток-мишеней;
- TNFRI(TNF Receptor-1, CD120a, DR2) - рецептор типа 1 для фактора некроза опухоли;
- DR3-DR6.Их лигандами являются: TRAIL (TNF-Related Apoptosis-Inducing Ligand) - для DR4 и DR5, TL1A и Tweak(TNF-related weak inducer of apoptosis) - для DR3 и N-APP -
для DR6.
◊ CD30на тимоцитах или T-лимфоцитах. Эта молекула тоже участвует в негативной селекции, связываясь с лигандом CD30L на эпителии и ДК мозговой зоны тимуса.
◊ Ядерный рецептор для глюкокортикоидов,индуцирующих апоптоз тимоцитов при позитивной селекции в тимусе и, вероятно, апоптоз активированных лимфоцитов в периферических тканях.
• Факторы транскрипции,образующиеся при активации лимфоцитов, - АP-1, NFAT - способствуют экспрессии рецепторов, индуцирующих апоптоз, что приводит к гибели лимфоцитов после выполнения ими своих функций. Этот феномен получил название «индуцированной активацией смерти клеток» (AICD - ActivationInduced Cell Death).
• Гены, продукты которых предотвращают апоптоз:Bcl-2, Bcl-xL, Bcl-w, Mcl-1, ALG-3 и др. Транскрипция этих генов происходит при получении клеткой «сигнала на выживание». Для B-лимфоцитов таким сигналом служит связывание BCR с антигеном, для тимоцитов - удовлетворительное связывание TCR с MHC при позитивной селекции, для периферических T-лимфоцитов - постоянное узнавание эндогенных пептидов в комплексе с MHC.
• Макрофаги и ДКсорбируют и поглощают апоптозные тельца с помощью интегринов, молекул CD36 и рецепторов-«мусорщиков», а затем разрушают их содержимое до мелких метаболитов. При этом ДК способны экспрессировать на мембране комплексы этих метаболитов с молекулами MHC-I и MHC-II - это лежит в основе развития иммунного ответа на собственные повреждённые ткани и тканевые антигены чужеродных трансплантатов.
В зависимости от механизмов запуска выделяют митохондриальный (эндогенный) и рецепторный (экзогенный) апоптоз. Развитие или защита от апоптоза определяется балансом про- и противоапоптотических факторов семейства Вcl-2 в мембранах митохондрий (рис. 9-1). Вcl-2 и Bcl-xL являются противоапоптотическими факторами, постоянно связанными с мембранами митохондрий, а Bax, Bim, Bik, Bak и т.д. - проапоптотическими факторами, способными циркулировать в цитоплазме. Включение программы митохондриального апоптоза индуцируется определёнными сигналами из цитоскелета, в результате чего противоапоптотические факторы релокализуются, димеризуясь с молекулой Bcl-2 в митохондриальной мембране и нейтрализуют её антиапоптотический потенциал. Проапоптотические факторы формируют димеры, образующие пору в митохондриальной мембране, через которую из митохондрии в цитозоль поступает цитохром С. Apaf-1 (Apoptotic peptidase activating factor 1) связывает цитохром С, и к этому комплексу подсоединяется димер прокаспазы 9. Формирующаяся надмолекулярная структура называется апоптосомой. В составе апоптосомы прокаспаза 9 превращается в активную каспазу 9 путём аутокаталитического отщепления N-концевого участка.
Каспазы - это сериновые протеазы, разрывающие полипептидную связь после остатка Asp (отсюда их название). Выделяют инициаторные и эффекторные каспазы. Каспаза 9 относится к инициаторным каспазам. Она, как и другие инициаторные каспазы, отщепляет фрагменты эффекторных каспаз (чаще всего каспазы 3), переводя их в активную форму. Митохондриальная форма апоптоза играет основную роль в
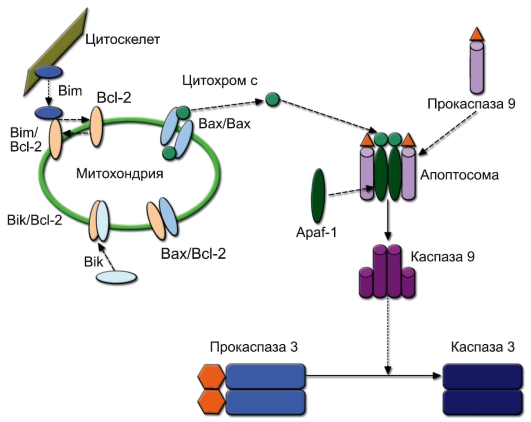
Рис. 9-1.Митохондриальный механизм запуска апоптоза. Пояснения см. в тексте
процессах морфогенеза, в том числе при положительной селекции Т-лимфоцитов.
Запуск апоптоза под влиянием внешних факторов (рецепторный апоптоз) обеспечивают рецепторы DR (от Death Receptor) - рис. 9-2. Следует отметить, что все рецепторы DR за исключением Fas могут также вызывать активацию NF-kB (индукция пролиферации и выживания). Рецепторы DR в цитоплазматической части содержат домен смерти DD (Death Domain), активация которого и запуск апоптотического сигнала происходят при тримеризации рецептора, вызываемой связыванием лигандов. Тримеризация рецепторов и их внутриклеточных DD придаёт последним способность образовывать так называемый «сигнальный комплекс». В случае рецепторов Fas и TRAIL это DISC (Death Initiating Signaling Complex), образуемый при взаимодействии с гомологичным DD доменом цитоплазматического адаптерного белка FADD (Fas-Associated
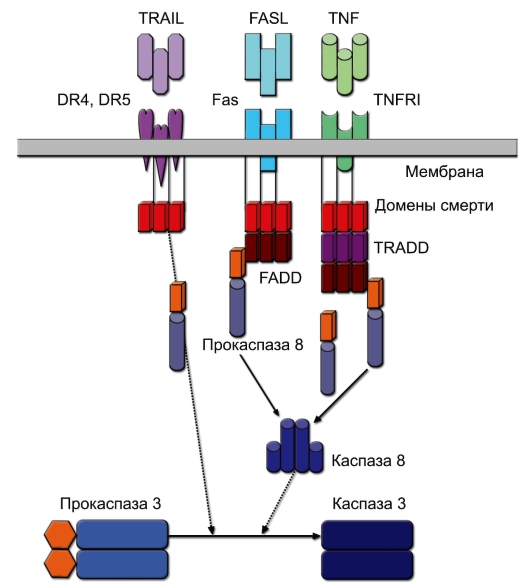
Рис. 9-2.Рецепторный механизм запуска апоптоза. Пояснения см. в тексте
Death Domain protein). В случае рецептора TNFRI, чтобы сформировать сигнальный комплекс 1 и обеспечить связывание с белком FADD, необходимо вначале рекрутировать белок TRADD (TNF-Related Death Domain protein).FADD кроме DD домена также содержит эффекторный DED-домен (Death Effector Domain), который приобретает сродство к гомологичному участку некоторых инициаторных прокаспаз, в типичном случае - прокаспазы 8 (а также каспазы 10). Связывание этих молекул приводит к аутокаталитическому отщеплению от каспазы 8 гомолога DED и формированию активной каспазы 8, способной активировать каспазу 3 и другие эффекторные каспазы. В некоторых клетках каспа-
за 8 может также запускать митохондриальный путь апоптоза через активацию фактора Bid.
Каспаза 3 и другие эффекторные каспазы имеют многочисленные молекулы-мишени, локализующиеся в ядре и цитоплазме. Расщепление этих мишеней определяет многообразные изменения морфологии и функции клетки, которые проявляются в процессе апоптоза. Основной мишенью эффекторных каспаз является Са2+Mg2+-зависимая эндонуклеаза - CAD (от Caspase-Activated DNAse). Этот фермент обусловливает разрывы ДНК между нуклеосомами. Конечным результатом многообразных изменений в клетке является её гибель, как полагают, наступающая в результате истощения энергетических ресурсов, которые тратятся на неэффективную репарацию разрывов ДНК. Гибель по механизму апоптоза проявляется в сморщивании клетки, конденсации хроматина, образовании отростков клеточной мембраны и, наконец, фрагментации ядра и всей клетки с образованием апоптотических телец.
Рецепторная форма апоптоза свойственна зрелым лимфоцитам при их взаимодействии с лигандами апоптоза, локализующимися на активированных клетках, а также с антигеном, цитокинами и т.д. Рецепторный апоптоз реализуется при отрицательной селекции тимоцитов и незрелых В-клеток.
СУПРЕССИЯ ИММУННОГО ОТВЕТА
Супрессия иммунного ответа в норме развивается по мере элиминации антигенов из организма. Элиминация антигенов означает устранение исходного причинного фактора активации лимфоцитов через TCR и BCR, в результате новые (наивные) лимфоциты становится «нечем» активировать.
Дата добавления: 2017-01-08; просмотров: 3110;











