Энтропийная (тепловая) T-S-диаграмма
Сжатие реального газа сопровождается изменением его объема, давления и температуры. Соотношение между этими параметрами при давлении не более 106 н/м2 (~10 am) характеризуется уравнением состояния идеальных газов.
При давлениях более 106 н/м2 (p>10 am) следует пользоваться уравнением Ван-дер-Ваальса или другим уравнением более точно описывающим зависимость между объемом, давлением и температурой газа при повышенных давлениях.
Процессы сжатия газа наглядно могут быть изображены на энтропийной, или тепловой, диаграмме Т–S (рис. 7-28).
На оси ординат этой диаграммы откладывается абсолютная температура (Т), по оси абсцисс – энтропия (S). Как известно из термодинамики, энтропия представляет собой некоторую функцию состояния тела, которая увеличивается при подводе к нему тепла, причем это увеличение тем меньше, чем выше температура тела.
Приращение энтропии при подводе тепла q дж/кг составляет при обратимом процессе
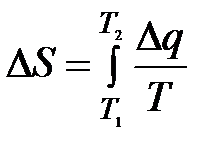 дж/кг∙град дж/кг∙град
| (7-31) |
На Т – S диаграмме нанесены линии, соответствующие постоянному давлению (изобары), и линии, соответствующие постоянной температуре (изотермы), которые изображаются горизонтальными прямыми. Линия АКВ является пограничной кривой. Область, лежащая ниже этой кривой, соответствует влажному пару, ветвь АК – жидкости при температуре насыщения, ветвь КВ – сухому насыщенному пару. Точка К является критической точкой. Слева от ветви АК находится область жидкости, справа от ветви КВ – область перегретого пара. Так как испарение и конденсация жидкости протекают при постоянных температурах и давлениях, то в области влажного пара изобары совпадают с изотермами. Конденсация смеси влажных паров протекает при переменной температуре, поэтому в таких случаях изобары в области влажного пара не совпадают с изотермами.
Кроме того, на Т–S – диаграмме (рис. 7-28) нанесены линии постоянной энтальпии (i = const). Энтальпия идеальных газов зависит только от температуры, и для таких газов линии i = const совпадают с изотермами. Энтальпия реальных газов зависит также от давления и для них линии i = const не совпадают с изотермами.
Процессы сжатия газа в компрессоре изображаются на диаграмме Т–S следующим образом. При адиабатическом сжатии q = 0, следовательно по формуле (7-31) ∆S = 0, т.е. процесс идет без изменения энтропии (S = const). Поэтому процесс изображается вертикальной линией 1–2, причем точка 1 характеризует состояние газа до сжатия и лежит на пересечении изобары p1 и изотермы T1; точка 2 отвечает состоянию газа после сжатия и лежит на изобаре, соответствующей давлению p2.
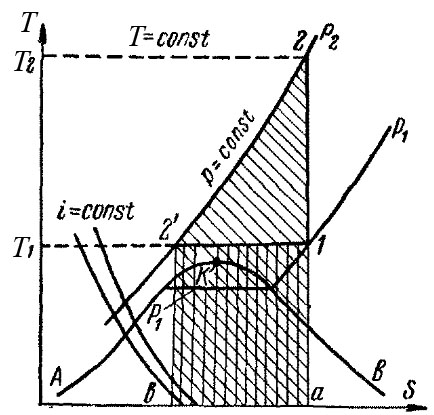
Рис. 7-28 – Диаграмма T–S процесса сжатия газа
При изотермическом сжатии процесс протекает при T=const и изображается горизонтальной линией 1–2' причем точка 2', характеризующая состояние газа после сжатия, лежит на изобаре p2. Количество отводимого тепла q, согласно формуле (7-31), составляет T∆S и на рис. 7-28 выражается площадью заштрихованного прямоугольника а–1–2'–b, высота которого равна T1, а основание – изменению энтропии ∆S. В данном процессе энтропия уменьшается, т.е. величина ∆S отрицательна. Поэтому количество тепла будет также отрицательным, т.е. процесс сопровождается, как указывалось выше, отводом тепла. Та же площадь а–1–2'–b выражает работу изотермического сжатия в тепловых единицах, а площадь а–2–2'–b на рис. 7-28 равна работе адиабатического сжатия.
Дата добавления: 2021-04-21; просмотров: 720;











