ФАЗОВЫЕ ПЕРЕХОДЫ В НЕФТИ, ВОДЕ И ГАЗЕ
Фазовые переходы подчиняются определённым закономерностям, в основе которых лежит понятие равновесия фаз. Равновесие фаз характеризуется константой равновесия, которая зависит от температуры и давления.
Константа фазового равновесия i-го компонента характеризуется отношением мольной доли компонента в газовой фазе (уi или Nyi) к мольной доле этого компонента в жидкой фазе (хi или Nxi), находящейся в равновесном состоянии с газовой фазой:
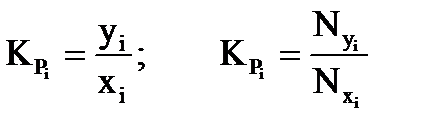 . (3.1)
. (3.1)
Для определения равновесного состояния газожидкостных смесей используются законы Дальтона и Рауля.
Согласно закону Дальтона каждый компонент, входящий в газовую фазу имеет своё парциальное давление Pi, а общее давление в газовой системе равно сумме парциальных давлений:
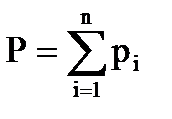 (3.2)
(3.2)
Согласно закону Рауля, парциальное давление компонента над жидкостью (нефтью) равно давлению насыщенного пара (Рнас. пара) или упругости пара (Qi) и этого компонента, умноженному на его мольную долю в нефти:
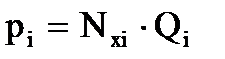 или
или 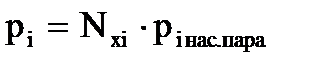 , (3.3)
, (3.3)
где Qi – упругость паров компонента;
Nxi – мольная доля компонента;
piнас. пара – давление насыщенного пара i-го компонента.
В момент равновесия парциальное давление i-го компонента в газовой фазе равно парциальному давлению компонента над жидкостью. И это описывается законом Дальтона-Рауля для равновесного состояния газовой и нефтяной фазы:
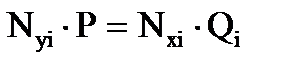 ; (3.4)
; (3.4)
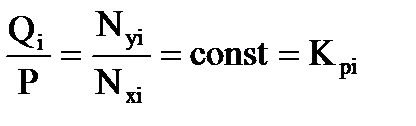 , (3.5)
, (3.5)
где Кi – константа равновесия i-го компонента при данной температуре и давлении смеси.
Оценить состав газовой (Nyi) и жидкой (Nxi) фаз можно на основе уравнения материального баланса, записанного для одного моля нефтегазовой смеси (Nzi):
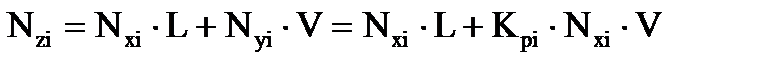 , (3.6)
, (3.6)
где L – мольная доля жидкой фазы;
V – мольная доля паровой фазы;
Nzi – мольные доли компонентов в нефтегазовой смеси.
По условию сумма мольной доли жидкой и паровой фаз равна единице. Отсюда:
V=1–L. (3.7)
Используя уравнения (3.6) и (3.7) получим выражение для мольной доли компонента жидкой фазы:
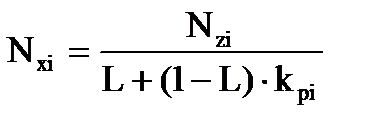 , (3.8)
, (3.8)
или
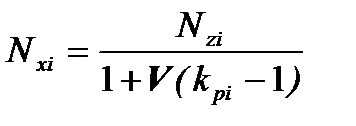 , (3.9)
, (3.9)
и для мольной доли компонента газовой фазы:
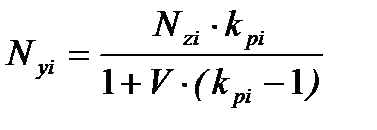 . (3.10)
. (3.10)
Величины: V и L оцениваются и уточняются методом последовательных проб и приближений (см. разд. "Практикум для самостоятельной работы"). .
Дата добавления: 2016-12-27; просмотров: 1726;











