Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г

| Он писал: "От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь". |
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
Чтобы получить сульфид железа(II), мы смешивали железо и серу в соотношении 7:4.
Посмотрите видео-эксперимент.
Если смешать их в другой пропорции, например 10:4, то химическая реакция произойдет, но 3 г железа в реакцию не вступит. Почему наблюдается такая закономерность? Известно, что в сульфиде железа (II) на каждый один атом железа приходится один атом серы. Следовательно, для реакции нужно брать вещества в таких массовых соотношениях, чтобы сохранялось соотношение атомов железа и серы (1:1). Поскольку численные значения атомных масс Fe, S и их относительных атомных масс Ar(Fe), Ar(S) совпадают, можно записать:Ar(Fe):Ar(S) = 56:32 = 7:4. Отношение 7:4 сохраняется постоянно, в каких бы единицах массы ни выражать массу веществ (г, кг, т, а.е.м.). Большинство химических веществ обладает постоянным составом.
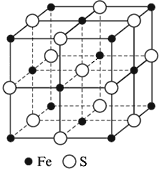 Рис. Кристаллическая решетка сульфида железа(II)
Рис. Кристаллическая решетка сульфида железа(II)
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые – бертоллидами(в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н2О, НCl, ССl4, СO2. Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
Дальтониды – вещества постоянного качественного и количественного состава, которые не зависят от способа их получения.
Бертоллиды – соединения переменного состава, не подчиняющиеся законам постоянства состава вещества и закону кратных отношений
Пример: V0.9-1.3, TiO1.46-1.56
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Cостав соединений молекулярной структуры, т.е. состоящих из молекул, - является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
На основе закона постоянства состава вещества можно производить различные расчеты.
Задача №1. В каких массовых отношениях соединяются химические элементы в серной кислоте, химическая формула которой H2SO4?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32, Ar(O)=16.
Определим массовые отношения этих элементов в формуле H2SO4
m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2 : 32 : 64 = 1 : 16 : 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г - Н, 16 г - S и 32 г - О.
Задача №2. Водород соединяется с серой в массовых отношениях 1:16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода.
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов: Ar(H)=1, Ar(S)=32.
Обозначим количество атомов водорода в формуле - х, а серы - у: НхSу
m(H) : m(S) = хAr(H) : уAr(S)= х1 : у32 = (2х1) : (1х32) = 2 : 32 = 1 : 16
Следовательно, формула сероводорода Н2S
Задача №3. Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и кислорода соответственно равны 2:1:2?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(Cu)=64, Ar(S)=32, Ar(O)=16.
Обозначим количество атомов меди в формуле - х, серы - у, а кислорода - z: CuxSyOz
m(Cu) : m(S) : m(O) = хAr(Cu) : уAr(S) : zAr(O) = x64 : y32 : z16 = (1х64) : (1х32) : (4*16) = 64:32:64 = 2:1:2
Дата добавления: 2021-04-21; просмотров: 857;











