Термодинамика биологических систем.
Термодинамика – наука о превращениях энергии при её переносе в макроскопических системах.
Макроскопические системы (макросистемы) – материальные объекты, состоящие из большого числа частиц.
Биологические системы – макроскопические. Обмен энергией с окружающей средой – обязательное условие их существования.
Особенности термодинамического подхода:
- Описание макросистем в целом (без учёта составляющих)
- Ограниченность – с помощью термодинамики нельзя исследовать природу или механизм биологического явления.
- Универсальность – приложимость к процессам самого разного рода от транспорта веществ через мембрану клетки до биологической эволюции.
«Теряя в частностях, мы приобретаем, в общем».
Основной вопрос, на который отвечает термодинамика – принципиальная возможность и направление протекания данного процесса.
В зависимости от характера взаимодействия с окружающей средой различают 3 типа систем:
- Изолированные системы – не обмениваются с окружающей средой ни энергией, ни веществом, так как внешняя среда на них не влияет.
- Замкнутые системы – обмениваются с окружающей средой энергией, но не веществом.
Совместно замкнутые и изолированные системы называют закрытыми. Закрытые системы – это те, которые не могут обмениваться с окружающей средой веществом.
- Открытые системы – обмениваются с внешней средой и энергией, и веществом.
Все биологические системы – открытые.
Физико-химические свойства системы (m, V, p, T) – её термодинамические параметры. Совокупность этих параметров определяет термодинамическое состояние системы. Изменение хотя бы одного из этих параметров ведёт к изменению термодинамического состояния в целом.
Любая функция, которая однозначно определяется термодинамическими параметрами – термодинамическая функция или функция состояния (при данных значениях параметра функции имеют одну и ту же величину, независимо от способа перехода к данному состоянию).
Состояние системы, при котором её способность совершить работу равна 0 и из которого она не может выйти самостоятельно (без притока энергии из вне) называется термодинамическим равновесием.
Процессы, протекающие в системе и изменяющие её состояние, могут быть:
- Обратимые – такие процессы, которые могут идти в обратном направлении без дополнительных изменений в окружающей среде. Они возможны лишь в изолированных системах в состоянии термодинамического равновесия.
- Необратимые – процессы, которые могут быть обращены только при условии дополнительных изменений во внешней среде.
1ое начало термодинамики характеризует количественную сторону превращения энергии.
2ое начало термодинамики характеризует качественную сторону, т.е. направленность процесса.
Первый закон термодинамики представляет собой частный случай закона сохранения и превращения энергии в применении к процессам преобразования тепла.
При всех процессах, происходящих в природе, энергия не возникает и не исчезает, а лишь превращается из одного вида в другой в эквивалентных количествах (Ломоносов).
Первый закон термодинамики постулирует существование функции состояния системы – «внутренняя энергия».
Внутренняя энергия (U) – сумма энергий всех видов движения и взаимодействия составляющих её частиц (сумма кинетической энергии движущихся частиц и потенциальной энергии взаимодействия их друг с другом).
В замкнутой системе: dU = dQ – dA. Изменение внутренней энергии замкнутой системы в итоге какого-либо процесса определяется разностью между полученным системой теплом и совершённой на её границе работой (химической, механической). От того, через какие промежуточные этапы совершается процесс, внутренняя энергия не зависит, поэтому и является функцией состояния системы. Если система термоизолированная, то dU = -dA.
В изолированной системе: dU = 0. Внутренняя энергия изолированной системы остаётся постоянной, независимо от характера протекающих в ней процессов.
В открытой системе: dU = d 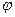 - dA, где d
- dA, где d 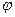 - суммарный поток тепла и вещества через границу системы. Изменение внутренней энергии открытой системы равно разности между суммарным потоком тепла и вещества и работы на границе системы с окружающей средой.
- суммарный поток тепла и вещества через границу системы. Изменение внутренней энергии открытой системы равно разности между суммарным потоком тепла и вещества и работы на границе системы с окружающей средой.
Экспериментальная проверка закона методами непрямой и прямой калориметрии подтвердила его справедливость, как для неживой, так и для живой природы.
Калориметрия– способ оценки теплового эффекта процесса.
Прямая калориметрия – непосредственное прямое измерение теплового эффекта.
Непрямая калориметрия – с расчётом по закону Гессе.
Закон Гессе: тепловой эффект химической реакции не зависит от ей промежуточных стадий, а определяется только исходным и конечными состояниями.
Этот закон используется для определения теплового эффекта превращения питательных веществ в углекислый газ и воду методом непрямой калориметрии: вещества сжигаются в калориметрической бомбе; при этом тепловой эффект получается такой же, как и при полном окислении этих веществ в организме.
Биологическая система, как и любая другая, не является источником какой-либо другой энергии.
Внутренняя энергия всех систем изменяется только в результате взаимодействия с окружающей средой.
Второй закон термодинамики постулирует существование особой функции состояния системы – энтропии (S).
Для обратимого изотермического процесса изменение энтропии равно количеству приведённого тепла, полученного системой.
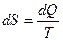 , где dQ – количество тепла, полученного системой при температуре T.
, где dQ – количество тепла, полученного системой при температуре T.
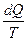 - приведённое тепло.
- приведённое тепло.
Очевидно, что речь идёт о замкнутой системе, на её границе имеет место теплопередача.
Физический смысл энтропии – формула Больцмана: 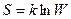 , где
, где
k – постоянная Больцмана
W – термодинамическая вероятность
Таким образом, энтропия – величина статистическая, она тем больше, чем больше термодинамическая вероятность данного макросостояния.
Энтропия – мера неупорядоченности системы.
В изолированных системах: энтропия изолированной системы возрастает, если протекающие в ней процессы необратимы (dS>0) и остаётся неизменной в обратимых процессах (dS=0). Необратимые процессы в изолированной системе приводят её в состояние термодинамического равновесия.
Свободная энергия – энергия Гельмгольца. 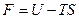
Термодинамический потенциал - энергия Гиббса. 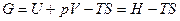
Энтальпия. 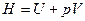 .
.
Свободная энергия и термодинамический потенциал убывают в ходе необратимых процессов и достигают минимума в состоянии термодинамического равновесия. Они характеризуют способность системы совершать работу.
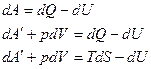
Если V и T постоянны, то 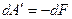 (изменение свободной энергии системы в обратимых процессах при условии постоянства температуры и объёма равно полезной работе).
(изменение свободной энергии системы в обратимых процессах при условии постоянства температуры и объёма равно полезной работе).
Физический смысл свободной энергии: это та часть (U - TS) внутренней энергии системы, которая может быть использована на совершение работы.
TS – связанная энергия – она может только рассеиваться в тепло. Она тем больше, чем больше энтропия.
Изменение термодинамического потенциала = полезной работе для обратимых процессов при условии постоянства давления и температуры.
Энергия Гельмгольца – изохорно-изотермический потенциал
Энергия Гиббса – изобарно-изотермический потенциал
Основной постулат неравновесной термодинамики: 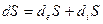 .
.
Изменение энтропии открытой системы складывается из 2 частей: потока энтропии через границу системы (взаимодействие с окр средой) и продукции энтропии внутри системы.
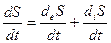 - скорости изменения энтропии
- скорости изменения энтропии
Согласно 2 закону термодинамики: 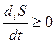 .
.
В случае изолированной системы, изменение энтропии обусловлено лишь продукцией энтропии в самой системе, т.е. первое слагаемое = 0.
1. 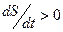 - общая энтропия возрастает (первый слагаемый больше нуля, либо первый слагаемый меньше нуля, но и меньше по модулю второго слагаемого).
- общая энтропия возрастает (первый слагаемый больше нуля, либо первый слагаемый меньше нуля, но и меньше по модулю второго слагаемого).
2. 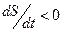 - общая энтропия уменьшается (первый слагаемый меньше нуля и больше по модулю второго слагаемого).
- общая энтропия уменьшается (первый слагаемый меньше нуля и больше по модулю второго слагаемого).
3. 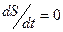 - общая энтропия неизменна (первый слагаемый равен по модулю но противоположен по знаку второму слагаемому).
- общая энтропия неизменна (первый слагаемый равен по модулю но противоположен по знаку второму слагаемому).
Продуцирование энтропии уравновешивается её оттоком – стационарное состояние.
| Термодинамическое равновесие | Стационарное состояние |
| Изолированная система Энтропия не меняется, не продуцируется Термод пар не меняются, экстремальны Система деградирована Идут только обратимые процессы (пр=обр) Градиенты отсутствуют | Открытая система Энтропия не меняется, продуцируется Термод пар не меняются, не экстремальны Система не деградирована Разность скоростей постоянна Существуют градиенты |
Сопряжение процессов в биологических системах:
При росте и развитии организма общая энтропия снижается за счёт выброса её в окружающую среду. Но в окружающей среде где-то энтропия возрастает. Поэтому в системе (биологическая система + внешняя среда) энтропия никогда не убывает.
Фотосинтез (образование сложных структур) - Деградация этих структур в ходе дыхания.
Уменьшение энтропии живых систем в процессе их жизнедеятельности – поглощение кванта света фотосинтезирующими организмами – образование энтропии в растениях.
Уменьшение энтропии организма при поступлении питательных веществ извне – продуцирование энтропии при образовании этих веществ в других участках внутренней среды.
Уменьшение энтропии в той части клетки, где идёт синтез – увеличение энтропии в той части клетки, где идёт распад.
Эндергонические реакции – реакции, в ходе которых свободная энергия возрастает, а энтропия падает (образование пептидных связей).
Экзергоническая реакция – реакция распада АТФ.
Критерий направленности процессов в биологических системах – продукция энтропии.
Принцип минимума продукции энтропии – теорема Пригожина:
В стационарном состоянии, близком к термодинамическому равновесию, продукция энтропии будет минимальна.
Это критерий общей направленности самопроизвольных процессов в открытой системе, вблизи от равновесного состояния.
Необратимые внутренние процессы в такой системе снижают скорость продукции энтропии. Значит система переходит в стационарное состояние из любого другого, близкого к нему. Стационарное состояние системы является устойчивым. В случае большого отклонения, система постепенно переходит в новое стационарное состояние.
Открытые системы вдали от состояния равновесия.
В таких системах возможно возникновение стационарного состояния с минимумом и максимумом продукции энтропии. При максимальной продукции – стационарное состояние неустойчиво. Происходит скачкообразные переход к новому состоянию.
Скачкообразное изменение параметров системы в момент выхода из неустойчивого состояния – фазовый переход. Система развивается через ряд неустойчивых стационарных состояний. Наблюдается постепенное отклонение системы от первоначальных данных. Когда это отклонение достигает критических пределов, то система становится неустойчивой. Осуществляется резкий переход к устойчивому состоянию. Пример: гомеостаз.
Если процесс протекает быстрее, чем система взаимодействует с окружающей средой, но в то же время столь же медленно, чтобы система успела к нему приспособиться, то к таким процессам применимы законы классической термодинамики. Пример: сборка и функционирование внутриклеточных структур.
| <== предыдущая лекция | | | следующая лекция ==> |
| ТЕПЛО- И МАССООБМЕН ПРИ СУШКЕ | | |
Дата добавления: 2021-02-19; просмотров: 435;











