Подходы к исследованию пищевой безопасности ГМО
Генетическая модификация организмов, используемых для изготовления пищевых продуктов или непосредственно употребляемых в пишу, не обусловливает обязательного привнесения в продукты питания экзогенных, вредных для здоровья человека агентов. По сравнению с исходными, считающимися безопасными организмами, ГМО содержит лишь несколько (2–3) новых генов наряду с 25–35 тысячами уже существующих, и соответственно в ГМО осуществляется синтез нескольких хорошо охарактеризованных с точки зрения безопасности молекулярных продуктов трансгенов. Тем не менее, генетическая модификация может так или иначе изменить уровень безопасности исходных организмов и традиционных продуктов.
Токсический (аллергенный) потенциал исходного организма-хозяина может возрасти по ряду причин. Во-первых, в результате встраивания трансгена возможно увеличение уровня продуцируемых естественных токсических веществ и антагонистов питательных веществ (эффект сверхпродукции), что в свою очередь может привести к росту уровня их потребления и к возрастанию вероятности неблагоприятного воздействия на здоровье людей. Во-вторых, токсический потенциал исходного организма-хозяина может вырасти вследствие изменения метаболизма и аккумуляции токсичных метаболитов. В-третьих, токсичным (аллергенным) для человека может все-таки оказаться сам продукт трансгена (например, если он принадлежит к белкам, не являющимся компонентами традиционных для производства продуктов питания организмов и не имеющим истории безопасного потребления).
Таким образом, оценка риска ГМО и ГМ продуктов питания необходима. Ее цели хорошо сформулированы в законодательстве государств ЕС, регулирующем поступление на рынок новых пищевых продуктов. В частности, в постановлении Европейской комиссии (ЕС) 1829/2003 регламентируется поступление на рынок ГМО для пищевых целей: продуктов питания, состоящих или включающих ГМО; продуктов питания, изготовленных из ГМО или содержащих ингредиенты, произведенные из ГМО. В соответствии с этим документом ГМО, предназначенные для потребления в пищу, не должны представлять риска для здоровья человека и окружающей среды и не отличаться в худшую сторону от ранее производимых продуктов по питательной ценности.
Успешное применение указанной выше процедуры оценки риска в приложении к ГМО и новым продуктам питания зависит во многом от возможности точно идентифицировать фактор риска. Если установлено, что в результате генетической модификации произошли изменения лишь отдельных компонентов пищевого сырья (добавились отдельные белки, изменилось содержание некоторых метаболитов), то традиционные подходы к исследованию токсичности полностью применимы для исследования ГМО. Напротив, если выяснится, что генетическая модификация имела следствием плейотропные эффекты, множественные изменения состава пищевых компонентов (так называемые непреднамеренные эффекты модификации), то идентифицировать отдельные потенциально токсичные, аллергенные агенты затруднительно. Следовательно, речь в данном случае должна идти не только об оценке риска отдельных химических (биологических) агентов, но об оценке риска целого продукта как комплекса важных для здоровья человека веществ.
Однако при оценке цельных пищевых продуктов традиционные подходы к оценке пищевой безопасности не всегда приемлемы. Во-первых, продукт является, как правило, сложным комплексом макро- и микропитательных веществ (макро-и микронутриентов), антагонистов питательных веществ, природных токсинов, характеризующихся значительной вариацией состава и питательной ценности. При этом в тестах по принудительному скармливанию цельного продукта животным невозможно оценить количественные параметры токсичности, относящиеся к каждому отдельному его компоненту. Во-вторых, пищевые продукты могут характеризоваться небольшими различиями между безопасным и очевидно опасным уровнем содержания природных токсических веществ (например, гликоалкалоидов), что осложняет расчет параметров NOAEL в опытах на животных и применение коэффициента « 100» для определения ADI. Для отдельных микропитательных веществ (например, витамина А) различие между полезными для здоровья и токсичными дозами потребления также чрезвычайно мало.
Более того, оценка продуктов питания как единого целого в тестах на животных проблематична сама по себе с точки зрения методики ее проведения. Необходимую минимальную дозу исследуемого продукта, сравнимую с дневным потреблением его человеком, очевидно, далеко не всегда возможно использовать в длительных опытах по скармливанию лабораторным животным (требуемая продолжительность субхронического теста на токсичность ГМО – 90 дней [FAO/WHO, 2000]). В данном случае неблагоприятные эффекты у лабораторных животных могут возникнуть не за счет воздействия потенциально вредных компонентов, а за счет нарушения баланса их пищевого рациона (продолжительного кормления фактически одним и тем же продуктом). Биологическое усвоение отдельных компонентов продукта животными также зависит от состава пищевого рациона в целом и может быть неестественным вследствие нарушения его баланса. Кроме того, у человека и животных различна чувствительность к ряду специфических токсинов. В таблице 2.2 представлены основные различия тестов на токсичность при оценке отдельных веществ с хорошо известной химической структурой и цельных продуктов питания.
Таблица 2.2
Различия между оценкой риска отдельных химических веществ и цельных продуктов питания
в тестах на лабораторных животных ( по [IFT, 2000])
| Оценка отдельных веществ | Оценка цельных продуктов |
| Обычно это отдельные, химически идентифицированные соединения | Сложная смесь многих соединений, большей частью не идентифицируемых |
| Наибольшая дозировка должна вызывать неблагоприятный эффект, относящийся исключительно к оцениваемому агенту | Наибольшая дозировка, не нарушающая пищевой рацион животных и не вызывающая питательного дисбаланса, маловероятно приведет к проявлению неблагоприятного эффекта |
| Низкие дозы обычно составляют менее 1% пищевого рациона | Высокие дозы обычно составляют более 10% пищевого рациона |
| Легко применять дозировки, достаточные для гарантированной безопасности (>100 × уровень потребления человеком) | Трудно или невозможно применять дозировки, превышающие более чем в несколько раз обычный уровень потребления. Поэтому нет коэффициента безопасности «× 100» |
| Острый токсический эффект очевиден | Острый эффект, иной, нежели вследствие несбалансированности питания, обычно отсутствует |
| Эффекты «питательности» обычно отсутствуют | Эффекты «питательности» обычно присутствуют |
| Специфический порядок метаболизма обычно может быть определен и оценен | Сложный метаболизм многих ингредиентов с обычно не идентифицируемым характером |
| Причины эффектов обычно ясны | Эффект обычно отсутствует; если он проявляется, то может быть обусловлен рядом причин, выделить из которых одну практически невозможно |
Таким образом, эффективная система оценки пищевой безопасности ГМО и новых продуктов должна строиться с учетом следующих фактов.
• Традиционное исходное сырье и традиционные продукты питания не являются объектами систематического химического, токсикологического анализа или анализа питательных свойств. Их безопасность основана на длительной истории безопасного использования человеком.
• Традиционные исследования на животных достаточно эффективны, если касаются известных токсических веществ, выделенных в чистом виде. Но они не могут быть столь же просто применимы к исследованию продукта питания как единого целого.
• Из-за трудностей традиционного токсикологического исследования и анализа риска в приложении к цельным пищевым продуктам для оценки пищевой безопасности требуется мультидисциплинарный подход, основанный на концепции существенной эквивалентности и принимающий во внимание как преднамеренные, так и непреднамеренные изменения, которые могут проявиться в ГМО или новых продуктах питания в результате генетической модификации.
2.5. Применение концепции существенной эквивалентности
для оценки безопасности ГМО и ГМ-продуктов питания
Как уже указывалось выше, полученные путем традиционной селекции организмы не являются объектом скрупулезного анализа потенциальной токсичности, аллергенности, хотя известно, что они могут содержать ряд вредных соединений. При этом на основании длительного исторического опыта допускается, что новая комбинация генов, созданная в процессе традиционной селекции организмов, используемых для производства продуктов питания, и определяющая ряд новых для них признаков, не будет представлять угрозы для здоровья человека (например, каждый новый сорт ячменя будет именно ячменем и уровень риска от употребления соответствующих продуктов не увеличится). Принимая во внимание данное допущение, а также методические проблемы, возникающие при исследовании цельных новых продуктов питания (ГМО как целого), в основу оценки их безопасности положена концепция существенной эквивалентности, разработанная экспертами OECD и дополненная FAO/WHO. Согласно определению OECD, концепция существенной эквивалентности предусматривает, что традиционные продукты или пищевое сырье могут служить базой для сравнения при оценке безопасности или питательной ценности новых продуктов. Данный сравнительный подход предусматривает, что: 1) традиционные продукты не являются абсолютно безопасными; 2) в случае, если новые продукты питания или их компоненты эквивалентны по существенным характеристикам традиционным продуктам или пищевым компонентам, их можно использовать таким же образом, не ожидая вредных дополнительных эффектов для здоровья человека.
Следовательно, безопасность нового продукта должна рассматриваться не вообще, а по отношению к традиционному аналогу. Определение «традиционный аналог» в приложении к ГМО или ГМ-продуктам означает близкородственный организм, его компонент или сходные продукты, для которых имеется значительный опыт безопасного потребления в качестве пищи. Главная цель оценки риска, построенной на концепции существенной эквивалентности, – скорее не попытка идентифицировать любой источник опасности, ассоциированный с продуктами питания, но идентифицировать новые или измененные «старые» опасности по сравнению с традиционным аналогом. Оценка сфокусирована, во-первых, на идентификации сходства и различия между новой пищей (сырьем) и традиционным аналогом; во-вторых, на оценке безопасности идентифицированных различий. Выбор аналога для сравнения весьма важен. Лучшим аналогом для определения существенной эквивалентности является исходный для генетической модификации организм (родительская, практически изогенная линия). Однако такой аналог не всегда доступен. В этом случае OECD рекомендует использование нескольких генетически близких контрольных образцов (других сортов того же вида растений, близких штаммов микроорганизмов, пород животных) или сходных продуктов, уже присутствующих на товарном рынке, чтобы определить, являются ли выявленные различия следствием естественной вариации либо следствием генетической модификации.
Существенная эквивалентность ГМО и аналога устанавливается путем демонстрации того, что значимые для оценки пищевой безопасности характеристики ГМО и новых продуктов сходны с таковыми у традиционных аналогов. Таким образом, анализ существенной эквивалентности предполагает, прежде всего, композиционный анализ ГМО (нового продукта) и его аналогов. При этом исследуются ключевые компоненты сравниваемых организмов (продуктов), которые наиболее важны для здоровья человека: питательные вещества и их антагонисты; токсичные вещества, аллергены и др.. Среди питательных ключевых веществ выделяют главные (жиры, белки, углеводы) и минорные (минералы, витамины); к антагонистам питательных веществ относятся в основном ингибиторы определенных ферментов. Под ключевыми токсинами подразумевают известные природные соединения и вещества, присутствующие в оцениваемом сырье или продуктах, обладающие существенной для здоровья человека токсической потенцией (например, соланин в картофеле).
Характер композиционного анализа при оценке пищевой безопасности (его масштабы, приемлемая точность) является предметом обсуждения, и единых критериев пока не выработано. Организация по экономическому сотрудничеству и развитию (OECD) в рамках своей деятельности разработала специальные Согласительные документы (Consensus Documents) по отношению к организмам, наиболее часто используемым для генетической модификации, где регламентированы обязательные для анализа существенной эквивалентности группы соединений [OECD, 2001]. Дополнительные исследования проводятся при необходимости, в зависимости от каждого рассматриваемого случая ГИД. При любых обстоятельствах композиционный анализ предполагает сотни отдельных биохимических исследований и является весьма дорогостоящим. В таблице 2.3 представлен, например, список некоторых ключевых компонентов ГМ масличного рапса, проанализированных для определения его существенной эквивалентности аналогам в рамках процедуры оценки риска при его высвобождении на товарный рынок в странах ЕС.
В предусмотренной процедуре определения существенной эквивалентности могут быть три варианта результатов: 1) ГМО ( ГМ-продукт) эквивалентен традиционному аналогу по существенным признакам; 2) ГМО (ГМ-продукт) эквивалентен традиционному аналогу по существенным признакам, за исключением целевых (привнесенных) признаков модификации; 3) ГМО (ГМ-продукт) не эквивалентен традиционному аналогу по существенным признакам. В первом случае (например, крахмал, полученный из генетически модифицированного картофеля) дальнейших тестов для определения безопасности не требуется (крахмал идентичен тому, который употреблялся многие годы ранее и не вызывал неблагоприятных эффектов).
| Таблица 2.3 | |
| Ключевые компоненты масла и семян генно-инженерного масличного рапса, проанализированные в рамках процедуры установления его существенной эквивалентности традиционным аналога | |
| Фирма – заявитель ГМ рапса, осуществлявшая оценку риска | Исследованные питательные и антипитательные ключевые компоненты |
| Plant Genetic Systems | Общее содержание масла |
| Уровень глюкозинолата | |
| Состав жирных кислот в масле | |
| Содержание эруковой кислоты (антипитательный компонент) | |
| Monsanto | Общее содержание белка |
| Общее содержание жиров | |
| Общее содержание углеводов | |
| Содержание волокон | |
| Профиль аминокислот | |
| Профиль жирных кислот | |
| Содержание эруковой кислоты | |
| Уровень глюкозинолата | |
| Уровень синапина | |
| 1 Представленные в таблице данные взяты из работы M.Y. Noordam et al. (1998). |
Во втором случае существенная эквивалентность установлена по важнейшим признакам, за исключением тех, которые определяются трансгенами. Поэтому дальнейшие исследования должны быть сфокусированы на безопасности проявления именно этих признаков (например, на безопасности эндогенного Bt-протеина в растениях ГМ кукурузы, картофеля, томатов). При этом молекулярные продукты трансгенов подвергаются интенсивному исследованию с точки зрения их вероятной токсичности, аллергенности. Анализируются вероятные непредвиденные эффекты вставки гена, изменения метаболических путей и содержания метаболитов. В случае не эквивалентности сравниваемых организмов (продуктов питания) проводятся наиболее полные исследования безопасности отличительных признаков ГМО (ГМ- продуктов). Объем и характер исследований зависят тогда от каждого конкретного случая оценки риска и диктуются выявленными особенностями исследуемого ГМО или ГМ-продукта, а также характером ГИД. Принципиальная схема процедуры оценки пищевой безопасности ГМО, основанная на концепции существенной эквивалентности, представлена на рисунке 2.2.
Анализ существенной эквивалентности является ключевым шагом в процессе оценки безопасности ГМО и ГМ-продуктов питания. Но это не оценка их безопасности сама по себе. Скорее это ее стартовая точка, которая заключается в биохимическом профильном анализе ГМО и ГМ-продуктов по сравнению с аналогами и которая определяет наиболее оптимальную линию дальнейшей оценки безопасности выявленных отличительных признаков. Так как, за редким исключением, целью генетической модификации является привнесение в организм нового признака, результатом обязательно будет различие ГМО и аналога, как минимум, по составу трансгенов и экспрессии соответствующих молекулярных продуктов трансгенов. Тогда собственно оценка риска выявленных существенных различий (единичных или множественных) проводится с целью установить, насколько уровень безопасности для здоровья человека ГМО и ГМ-продуктов отличается от такового, присущего их аналогам.
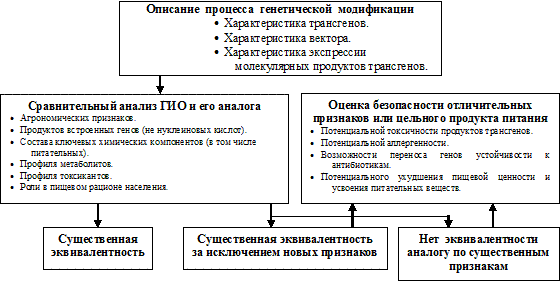
Рис. 5.2. Стратегия оценки безопасности новых продуктов питания, построенная на принципе «существенной эквивалентности» (модифицированная схема Н.А. Kuiper [1998])
Концепция существенной эквивалентности неоднозначно принимается научными кругами и общественностью. Она подвергалась критике как псевдонаучная и неприемлемая для оценки риска ГИД. Противники данного подхода, прежде всего, подчеркивают, что сам термин «существенная эквивалентность» не определяет специфику нужных исследований и вызывает разночтения. Например, H.I. Miller (1999) указывает, что «существенная эквивалентность не претендует на научную формулировку; это концептуальное средство для производителей новых продуктов и правительственных, регулирующих безопасность организаций; она не определяет, не ограничивает специфичность и количество тестов, необходимых для оценки пищевой безопасности». Подчеркивается, что существенная эквивалентность – это не более чем утверждение, указывающее на аналогию. В то же время, чтобы научно доказать или опровергнуть данное утверждение, нужны основанные на статистике результаты масштабных анализов, которые подтверждают либо отвергают нулевую гипотезу. Критики концепции аргументируют, что в отношении многих высвобожденных ГМ-растений в США и Канаде их существенная эквивалентность аналогам была подтверждена лишь композиционным анализом ограниченного числа соединений и более их безопасность никогда не оценивалась. Демонстрация их существенной эквивалентности аналогам в отношении потенциальной токсичности и аллергенности ограничивалась анализом исключительно целевых продуктов трансгенов. Кроме того, высказывалось мнение, что современное состояние знаний в генетике не позволяет с достаточной степенью определенности судить о взаимоотношениях между генами, химическим составом и потенциальной токсичностью пищевых компонентов. Поэтому невозможно отделить существенные признаки для анализа эквивалентности от признаков несущественных. Ряд исследователей придерживаются мнения, что оценка риска для новых продуктов питания должна проводиться в рамках традиционной процедуры токсикологических исследований с определением показателя ADI (без анализа существенной эквивалентности). Однако, как уже было указано выше, такой подход применим только к отдельным веществам (например, к хорошо известным белкам с определенной структурой, которые могут быть синтезированы в микробиологических системах и скармливаться лабораторным животным в нужных дозах без ущерба для общей питательной ценности пищевого рациона). С точки зрения ГМО и ГМ-продуктов питания процедура, основанная на концепции существенной эквивалентности, является на сегодняшний день, по коллегиальному мнению экспертов ряда компетентных международных организаций, наиболее удачной и подходящей стратегией оценки риска. В то же время они отмечают, что данный подход должен развиваться и изменяться с учетом новых научных знаний и аналитических возможностей.
2.6. Процедура оценки риска ГМ продовольственного сырья
и продуктов питания
Как уже отмечалось в главе 1, принятая в мировой практике методика оценки риска генно-инженерной деятельности предусматривает идентификацию всех возможных ее неблагоприятных эффектов (прямых и опосредованных, проявляющихся сразу и отдаленных) и анализ вероятных последствий их проявления. С точки зрения ГМ пищевых продуктов оценка риска включает в себя следующие этапы: идентификацию факторов риска для здоровья человека, обусловленных генетической модификацией живых организмов (а не всех, присущих данному продукту); если таковые идентифицированы – определение вероятности их вредного воздействия и масштаба этого воздействия. Согласно концепции существенной эквивалентности, процедура оценки риска должна включать сравнительный анализ ГМ продуктов питания с их традиционными аналогами, сфокусированный на определении сходств и различий между ними. Если обнаружены новые по сравнению с аналогом факторы риска или произошло изменение ранее присутствовавших факторов, риск, ассоциированный с ними, должен быть адекватно оценен. При этом основными направлениями оценки риска перед высвобождением новых продуктов на товарный рынок являются следующие:
• Безопасность любых непреднамеренных эффектов модификации (изменения состава ключевых компонентов, путей метаболизма).
• Безопасность белков-продуктов трансгенов (токсический, метаболический эффекты).
• Изменение аллергенного потенциала (аллергенность белков – продуктов трансгена, изменение аллергенности вследствие плейотропного эффекта генетической модификации).
• Снижение питательной ценности и изменение роли ГМ продуктов (их компонентов) в пищевом рационе групп населения.
• Возможность переноса маркерных генов устойчивости к антибиотикам микрофлоре желудочно-кишечного тракта и снижения вследствие этого эффективности традиционной терапии.
Методика оценки пищевой биобезопасности построена на научных принципах, изложенных нами ранее. Оценка риска включает как анализ цельных продуктов питания, так и отдельных их компонентов в сравнении с соответствующими аналогами. При этом во внимание принимаются как преднамеренные, так и непреднамеренные эффекты генетической модификации. В целом оценка пищевой безопасности представляет собой последовательный, шаг за шагом, процесс анализа информации и данных исследований, относящихся к изучаемой проблеме. Ниже представлена общая структура оценки безопасности продуктов питания, изготовленных из ГМ-растений (являющихся ГМ-растениями или включающих компоненты из ГМ-растений), так как именно эта категория ГМ-продуктов питания превалирует на товарном рынке. Этапы процедуры оценки риска продуктов питания, изготовленных из иных ГМО, принципиально сходны, хотя в данном случае могут приниматься во внимание и другие факторы в зависимости от каждого оцениваемого продукта. Процедура оценки риска продуктов, изготовленных из ГМ-растений, включает среди прочих этапов анализ процесса генетической модификации, а именно:
• описание модифицированного организма (исходного сырья);
• описание исходного (реципиентного) организма и порядка его использования в качестве пищи;
• описание организма-донора;
• описание процесса генетической модификации;
• характеристику генетической модификации.
На данном этапе собирается и анализируется имеющаяся информация об исходных организмах и ГМО. Особенно важна информация о тех признаках исходных организмов, которые представляют угрозу здоровью человека: об уровне их токсичности, аллергенности. Значима также информация о порядке и истории безопасного употребления в пищу исходных для модификации организмов, о принятых методах их переработки и влиянии на токсичность конечных продуктов. Кроме того, анализируется информация о способе трансформации (генетической модификации), о полном составе введенной конструкции ДНК, включая селективные гены устойчивости к антибиотикам, о целевых кодируемых признаках и их экспрессии. На указанном этапе анализа важно показать, что гены организма-донора, ответственные за продукцию токсических и антипитательных веществ, не входили в состав трансгенной конструкции.
Для определения непреднамеренных эффектов модификации весьма важна информация о том, затронула ли вставка трансгена уникальные кодирующие последовательности ДНК организма-хозяина или регуляторные последовательности (что может привести к изменению экспрессии генов исходного организма). С этой точки зрения желательно также получить сведения об открытых рамках считывания во вставленной конструкции и прилегающих районах генома реципиентного организма, которые могут инициировать синтез новых, нецелевых продуктов. В результате анализа указанной информации на данном этапе оценки риска устанавливается вероятность переноса от организма-донора генов, отвечающих за синтез потенциально опасных для здоровья человека веществ; определяется природа новых белков – продуктов трансгена и порядок их экспрессии; устанавливается вероятность непреднамеренных эффектов модификации (возможность изменения исходного потенциала токсичности, аллергенности).
Далее следует этап инструментального (практического) анализа безопасности ГМО и ГМ- продуктов. Он включает, во-первых, сравнительный анализ состава ключевых компонентов (композиционный анализ) и оценку метаболитов. Данный этап очень важен как для анализа существенной эквивалентности ГМ и традиционных продуктов, так и для собственно анализа риска выявленных отличий в составе компонентов и метаболитов ГМО. Проводимые исследования должны быть сфокусированы на доказательстве того, что уровень продукции компонентов, характеризующих исходный потенциал токсичности, аллергенности, питательной ценности, существенно не изменился в результате непреднамеренных эффектов модификации. Кроме того, данные этого этапа оценки риска показывают возможные изменения путей метаболизма и характера аккумуляции метаболитов, представляющих угрозу для здоровья человека.
Дальнейшим шагом оценки риска является инструментальная оценка биобезопасности экспрессирующихся в ГМО целевых продуктов трансгенов (не нуклеиновых кислот), которая заключается в определении их вероятной токсичности и аллергенности. Проводимые здесь исследования должны быть сконцентрированы на химической природе и функциях новых синтезируемых веществ; на доказательстве того, что гены донора, определяющие синтез неблагоприятных для здоровья продуктов, не перенесены в ГМО. Если продукты трансгена не являются известными веществами с длительной историей безопасного употребления в пищу или уровень их экспрессии достоверно превышает таковой у аналога, то проводятся принятые исследования токсичности (см. ниже).
Для оценки риска существенна также оценка изменения питательной ценности (питательного профиля) исходных организмов вследствие генно-инженерной модификации. Такое изменение может быть следствием как преднамеренных (направленных на улучшение питательной ценности), так и непреднамеренных эффектов. Оценка данного фактора риска проводится на основании результатов композиционного анализа, показывающих характер изменения ключевых макро- и микропитательных веществ. В процессе оценки устанавливаются возможные последствия таких изменений для здоровья человека (если они идентифицированы). Для этого вначале рассчитывается наиболее вероятный и максимальный уровень потребления ГМ-продуктов питания в составе общего пищевого рациона анализируемой популяции людей. Затем проводится расчет возможных неблагоприятных эффектов в результате изменения их питательной ценности. При этом во внимание принимаются физиологические особенности и особенности метаболизма специфических групп населения – грудных детей, подростков, взрослых людей, кормящих матерей и т.д. Кроме вышеуказанных рисков при оценке пищевой биобезопасности оценивается риск, связанный с использованием маркерных генов устойчивости к антибиотикам.
При оценке безопасности новых продуктов питания используются современные, адекватные научные методы в соответствии с рекомендованными Правилами «Хорошей лабораторной практики» [OECD, 1992; 2001]. Цель каждой оценки – в свете научных знаний достичь уверенности, что употребление в пищу новых продуктов не вызывает неблагоприятных последствий для здоровья человека, когда она изготовляется, используется (поедается) предполагаемым образом. Ожидаемым результатом такого анализа будет заключение, является ли новый пищевой продукт в такой же степени безопасным, как его традиционный аналог. Природа основных факторов риска для здоровья человека, характерных для оценки безопасности ГМО и ГМ-продуктов, и соответствующие методы оценки риска изложены в последующих разделах.
2.7. Оценка риска непреднамеренных эффектов
генетической модификации
В идеальном случае ГМО отличается от своего аналога только экспрессией целевых молекулярных продуктов модификации. Упрощенная модель такой генетической модификации следующая.
• В определенном, единственном участке генома организма-хозяина встроена новая последовательность ДНК (ДНК трансгена).
• Происходит транскрипция одной новой мРНК, комплементарной трансгену.
• Происходит синтез нового белка вследствие трансляции новой мРНК (если трансген кодирует белок).
• Появляется новая каталитическая активность, определяемая новым белком (если он относится к ферментам).
• Изменяется пул соответствующих метаболитов.
Предполагается, что такая линейная последовательность событий, инициированных трансформацией, не затрагивает активность других генов и процессов. Иными словами, новые возможные риски определяются только новым трансгенным признаком, и процедура оценки фокусируется исключительно на нем. Однако линейная модель генетической модификации, как свидетельствует имеющийся научный опыт, не всегда адекватно описывает действительные процессы в биологических системах, которые включают в себя сложные, многоуровневые взаимодействия между компонентами клетки. Вместе с проявлением целевых признаков генетической модификации (преднамеренный эффект) в результате вставки чужеродной ДНК в ГМО могут проявляться дополнительные признаки или предсуществующие признаки могут претерпеть изменения (непреднамеренный эффект). Непреднамеренные эффекты генетической модификации (НЭГМ) теоретически могут возникать в результате случайного встраивания последовательностей ДНК в геном растения, вызывающего прекращение экспрессии или изменение уровня экспрессии ранее активных генов, начало экспрессии ранее «молчавших» генов. Кроме того, такие эффекты могут быть следствием изменения особенностей метаболизма у реципиентного организма. Одни НЭГМ могут быть частично предсказуемыми на базе знаний о процессе трансформации, месте встраивания трансгена, функциях его продуктов (включая влияние на метаболизм). Другие НЭГМ являются непредсказуемыми (область научной неопределенности).
Непреднамеренные эффекты генетической модификации не являются атрибутом только биотехнологии, они могут быть следствием и традиционной селекции живых организмов – исходных для изготовления продуктов питания. НЭГМ могут быть вредными, благоприятными и нейтральными по отношению к самому модифицируемому организму и к здоровью человека. Анализ безопасности ГМО и ГМ-продуктов питания должен исключить проявление вредных для здоровья человека непреднамеренных эффектов генетической модификации. Учитывая природу НЭГМ, наиболее прогнозируемым их следствием является изменение качественного и (или) количественного состава определенных химических соединений ГМО по сравнению с исходным организмом. Поэтому НЭГМ идентифицируются в рамках установления существенной эквивалентности ГМО и аналогов путем проведения широкого спектра сравнительных биохимических исследований.
Для идентификации НЭГМ могут применяться различные стратегические подходы: целевой и нецелевой. В случае целевого подхода исследуется ограниченный ряд ключевых химических компонентов ГМО и ГМ-продуктов питания, существенных для здоровья человека, содержание которых могло быть непреднамеренно изменено вследствие генетической модификации. Чем больше компонентов ГМО (ферментов, метаболитов) анализируется, тем больше вероятность обнаружить НЭГМ. Такой подход пока является наиболее часто применяемым и достаточно эффективным. В частности, при проведении экспертизы безопасности трансгенной сои, устойчивой к гербициду глифосату, было проведено около 1400 отдельных анализов. Их результаты показали существенную эквивалентность ГМО и исходной линии как по «питательным», так и «антипитательным» свойствам. В качестве первых оценивали: содержание белка, жира, волокон, зольных элементов, углеводов, калорийность и влажность зерна. Кроме того, определяли «питательные» свойства переработанного зерна, сухой муки и обезжиренной муки, очищенного белкового компонента, лецитина, очищенного и дезодорированного масла и т.п. Не было выявлено различий ГМО и аналога также по составу и содержанию специфических жирных кислот, составу аминокислот, в частности по содержанию ароматических аминокислот (толерантность к глифосату трансгенной сои связана с ключевым ферментом метаболизма ароматических аминокислот EPSPS – 5-енолпирувилшикимат-З-фосфатсинтетазы). Естественно, особое внимание было уделено антинутриентам соевого зерна: ингибитору трипсина, лектинам, фитоэстрогенам (генистеину и додзеину), стахиозе и фитату. По содержанию этих веществ ГМО и исходная линия также не различались.
В качестве примера обнаружения НЭГМ при такой стратегии исследования можно привести исследования так называемого «золотого риса». Целью генетической модификации в данном случае было увеличение содержания β-каротина в зернах (как вещества, полезного для здоровья – источника витамина А) для восполнения дефицита этого витамина у определенных групп населения развивающихся стран. Но наряду с целевым эффектом в названном сорте риса выявили нежелательное накопление ксантофилла (желтого пигмента). Иные примеры проявления НЭГМ, обнаруженные при целевой стратегии исследования, представлены в таблице 2.4.
Ограничением целевой стратегии при анализе НЭГМ является возможное появление в ГМО неизвестных токсических компонентов или пищевых антагонистов, которые не имели истории потребления человеком и соответственно не могут являться целью идентификации.
Альтернативным подходом к определению НЭГМ (и существенной эквивалентности) является так называемый нецелевой подход, в котором используются профильные аналитические методы. Тысячи генов согласованно экспрессируются в эукариотических клетках и интегрированно «отвечают» на многие внеклеточные и внутриклеточные управляющие факторы. Такая интегральная картина экспрессии генов служит уникальным чувствительным индикатором текущего состояния клеток и тканей. Профильные аналитические методы позволяют определить статус экспрессии генов и обнаружить качественные и количественные изменения состава многочисленных (не обязательно ключевых) химических соединений на внутриклеточном уровне. Порядок экспрессии генов в клетках оценивается по составу транскриптов (мРНК), по профилю белков и метаболитов. Профильный анализ выявляет полный спектр определенных классов химических соединений в клетках и тканях безотносительно к их биологической функции и тем самым дает
Дата добавления: 2022-05-27; просмотров: 134;










