Специфичность действия ферментов
Понятие Е·S комплекса и АЦФ тесно взаимосвязаны с особым свойством ферментов – их специфичностью. По степени специфичности (в порядке ее снижения) различают:
I. Стереохимическую субстратную специфичность – в этом случае ферменты катализируют только 1 форму S (1 изомер). Например, фумаратгидратаза катализирует только превращение фумаровой кислоты, но не катализирует превращение ее изомера – малеиновую кислоту.
II.Абсолютную субстратную специфичность – Е превращает только 1S. Например, уреаза превращает только мочевину.
III. Абсолютная групповая S-ную специфичность. Ферменты действуют на группу сходных S-в. Например, алкоголь ДГ превращает не только этанол, но и другие алифатические спирты.
IV. Относительную групповую S-ную специфичность. Фермент воздействует не на группу молекул S, а на определенные связи определенных групп S-в. Например, пепсин и трипсин специфичны по отношению к пептидным связям в различных белках.
V. Относительную S-ную специфичность. Фермент катализирует, превращаясь в S-в, относящимся к различным группам химических соединений. Например, фермент цитохром-450 катализирует реакции гидроксилирования до 7000 разных S-в. Это наименее специфичная ферментная система.
Существует две теории объяснения специфичности ферментов.
Гипотеза Э. Фишера – гипотеза «ключа и замка» или гипотеза «шаблона». По Фишеру, фермент – это жесткая структура, АЦФ которого - точный «слепок» S-та. Если S подходит к Е как ключ к замку, то реакция произойдет. Если же S немного изменен («ключ»), то он не соответствует АЦФ («замку»), и реакция становится невозможной. Несмотря на логичность такого объяснения, гипотеза Фишера не объясняет, на чем тогда основаны абсолютная и относительная групповая специфичность. Например, цитохром-450 соединяется с таким большим количеством S-в, различных по строению.
Эти внешние противоречия объясняет гипотеза Кошленда, или гипотеза вынужденного соответствия. По мнению Кошленда, молекула фермента не «жесткая», а гибкая структура и конфигурация фермента и его АЦФ начинают изменяться в момент присоединения фермента к S или другим лигандам. При образовании Е-S комплекса кроме геометрической комплементарности имеет место и электростатическая, которая осуществляется благодаря спариванию противоположно заряженных молекул Е и S. В действительности, видимо, имеют место оба варианта присоединения.
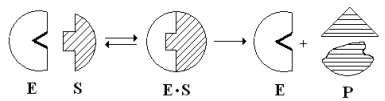
Гипотеза Кошленда позволяет объяснить, почему происходит превращение близких аналогов S-в. Если «ложный» субстрат (квази-S) отличается от природного и АЦФ принимает конформацию близкую к истинному субстрату, то расстановка каталитических групп в таком Е-S комплексе позволит осуществить реакцию. Этот «обман» фермент как бы не замечает, хотя реакция идет и не так быстро, как с истинным субстратом. Если конфигурация квази субстрата не позволяет правильно расположиться каталитической группе, то в этом случае реакция не пойдет. Т.е. если диапазон конформационных перестроек ограничен до одной единственно возможной, то фермент высокоспецифичен, а если возможности перестройки АЦФ велики, то фермент срабатывает и на квази субстраты.
Зависимость Vфр от рН-среды
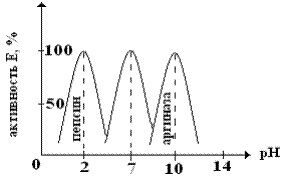
| Для каждого фермента имеется свой оптимум рН, при котором Vфр максимальна. Отклонение рН в ту или другую сторону ведет к снижению активности фермента. Большая часть ферментов имеет рН~7,0 то есть он совпадает с физиологическими значениями рН. |
При оптимальном значении рН функциональные группы АЦФ и сам S находятся в наиболее предпочтительной для связи форме. Некоторые ферменты имеют оптимальную рН, резко отличающиеся от физиологических значений, пепсин на 100% активен при рН = 1,5-2,5; аргиназа – при рН = 10.
Зависимость Vфр от температуры
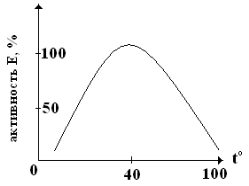
| С повышением температуры среды Vфр увеличивается, достигает оптимальных величин ~ 20-40ºС для большинства ферментов. Термолабильность ферментов связана с их белковым строением: при повышении температуры до 40-50ºС и выше, происходит их денатурация. |
Для некоторых ферментов денатурации наступает при 0ºС.
Для любых химических реакций при повышении температуры на каждые 10ºС V реакции увеличивается в 2-3 раза, для ферментативных реакций этот коэффициент ниже – 2 и даже меньше. Исключение: термостабильный фермент адениматциклаза выдерживает температуру 100ºС, а фермент каталаза активен при 0ºС.
Зависимость Vфр от конц. S.
Механизм действия ферментов описывается уравнением Михаэлиса-Ментен. Установить зависимость Vфр от [S] можно графически.
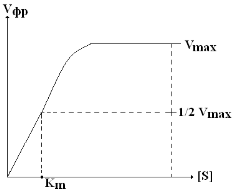
| а) по кривой Михаэлиса: чем меньше Km, тем больше Vm и тем выше сродство E к S.
Vmax соответствует состоянию полного насыщения фермента S-том.
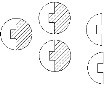 в растворе избыток Е (3 мол S, 5 мол Е) это участок насыщения фермента S-том.
в растворе избыток Е (3 мол S, 5 мол Е) это участок насыщения фермента S-том.
|
б)методом обратных величин Лайнцивера-Берка, где зависимостьVфр от [S] рассчитывают в обратных величинах.
Дата добавления: 2016-11-29; просмотров: 1872;











