С расплавами на основе железа
Атмосферный азот представляет собой постоянную по составу смесь двух устойчивых его изотопов N14, составляющий в нем 99,62 % и N15 – соответственно 0,38 %. Благодаря особенностям строения электронных оболочек, соседние атомы азота попарно объединяются с образованием прочных ковалентных связей 2р-орбит, сопровождающимся выделением огромной энергии (940,81 Дж/моль). Степень диссоциации молекул азота- "a", определяется уравнением:
Кр=(4a2/1–a2)Р, (139)
где Кр – константа равновесия процесса диссоциации молекул азота;
Р – давление.
Она весьма невелика при температурах выплавки стали, включая даже дуговую и плазменную плавку. Поэтому металл фактически контактирует и взаимодействует с молекулярным азотом.
При нормальных условиях и при всех температурах, могущих интересовать металлургов, молекулярный азот химически мало активен и равновесное распределение его между газообразной фазой и жидким металлом всегда достигается очень нелегко – после длительных выдержек.
Как это впервые было доказано Сивертсом, в равновесных условиях концентрация азота в расплавленных железе и сплавах на его основе и в твердом металле связана с его парциальным давлением уравнением "квадратного корня".
[N]=KN 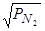 , (140)
, (140)
где KN – константа равновесия растворения азота, зависящая для сплава данного состава от температуры;
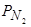 – парциальное давление молекулярного азота.
– парциальное давление молекулярного азота.
Такая зависимость растворимости азота от давления позволяет считать, что азот растворяется во всех металлах, к которым применим "закон квадратного корня", в атомарном состоянии или в форме нитридов, характерной особенностью которых является существование лишь одного атома азота в каждой молекуле нитрида. Итак, растворение азота в металлах и сплавах представляет собой сложный процесс
I этап N2=2Nадс, DНдис+DНадс
II этап 2Nадс=2[N] или, при образовании нитрида ме
талла 2Nадс+2n[Me]=2[MenN], DHраст
В связи с большой прочностью молекул азота, их диссоциация и адсорбирование на поверхности металла при каждой данной температуре определяется только природой самого металла и его "сродством" к азоту. Общий тепловой эффект обоих этапов процесса растворения азота (DHS) для большинства сплавов железа и для многих, даже нитридообразующих, металлов отрицателен вследствие огромной энергии образования двухатомных молекул N2.
Он определяется в соответствии с уравнением Вант-Гоффа, которое в случае растворения двухатомного газа принимает форму:
dlnSN/dT=DHS/2RT2, (141)
где SN – растворимость азота при 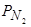 =0,1 Мпа;
=0,1 Мпа;
DHS – суммарное изменение энтальпии системы при растворении молекулярного азота в металле, т.е.
HS=DНдис+DНадс +DHраст
В зависимости от природы и строения растворяющего азот металла, DHS может быть как положительной, так и отрицательной (когда DНадс+DHраст очень значительны). В связи с этим растворимость азота, например, в расплавленном железе (при DHS>0) увеличивается с повышением температуры. В других металлах, образующих прочные нитриды, например Са или Li (DHS<0), растворимость азота понижается при понижении температуры.
Природа процесса растворения азота в расплавленных и твердых металлах полностью еще не выяснена. В большинстве случаев считают, что, подобно таким элементам как водород, кислород и углерод, азот склонен к образованию в металлах фаз внедрения. Особенно много общего следует ожидать в поведении азота и углерода: они являются соседями по таблице Д.И. Менделеева, обладают близкими атомными весами, размерами атомов и сходными структурами электронных оболочек. В связи с этим, геометрическое соответствие позволяет предполагать, что азот, как и углерод, растворяются в виде катионов с сохранением при этом наружной электронной оболочки 2s2. Расположение многозарядных катионов N3+ и C4+ в междоузлиях кристаллической решетки возможно только в тех случаях, когда эффективные размеры этих катионов не превышают размеры пор или "пустот" в кристаллической решетке, которые составляют 0,41 и 0,29 от размера атомов металла для октаэдрической и тетраэдрической пор соответственно.
Расположение катионов N3+ и C4+ в кристаллической решетке приводит к поляризации их и к снижению их эффективного заряда. Хорошо известно сходное влияние азота и углерода на полиморфные превращения железа. С вышеописанным, однако, контрастирует резкое повышение растворимости азота в аустените уже не в атомарной форме, а в форме нитрида FeyN, где ему (азоту) принадлежит роль аниона (рис. 50).



Для сталеплавильщиков большой интерес представляет вопрос о влиянии примесных и легирующих элементов на растворимость азота в расплавах на основе железа. Он исследовался рядом металлургов и сейчас относится к числу хорошо изученных. Широкую известность приобрели данные о влиянии концентрации отдельных компонентов бинарных сплавов на растворимость в них азота при t=1600 °С [61] (рис. 51, а, б) и вычисленные по этим экспериментальным данным значения равновесных (с 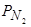 =0,1 МПа) при этой температуре активностей азота в расплавах, а также параметре взаимодействия первого порядка для азота и элемента R, т.е.
=0,1 МПа) при этой температуре активностей азота в расплавах, а также параметре взаимодействия первого порядка для азота и элемента R, т.е.
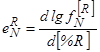 . (142)
. (142)

Хотя имеющиеся справочные данные по Шенку [10] и Эллиотту [9]не полностью согласуются между собой, в таблице 11 приведены значения 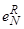 , опубликованные в работах [158,160] для t=1600 и I200 °C.
, опубликованные в работах [158,160] для t=1600 и I200 °C.
Таблица 11 – Параметры взаимодействия первого порядка 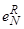 для сплавов Fe-N
для сплавов Fe-N
| Элемент | 1600 °C | 1200 °C |
| Бор | 0,085 | - |
| Углерод | 0,13 | 0,11 |
| Кислород | 0,00 | 0,00 |
| Алюминий | -0,028 | - |
| Кремний | 0,048 | 0,044 |
| Фосфор | 0,050 | 0,074 |
| Сера | 0,013 | - |
| Титан | -0,045 | - |
| Ванадий | -0,93 | -0,18 |
| Хром | -0,045 | -0,095 |
| Марганец | -0,020 | -0,035 |
| Кобальт | 0,011 | 0,0135 |
| Никель | 0,010 | - |
| Медь | 0,006 | - |
| Мышьяк | 0,018 | - |
| Цирконий | -0,63 | - |
| Ниобий | -0,073 | - |
| Молибден | -0,010 | -0,05 |
| Олово | 0,006 | - |
| Сурьма | 0,009 | - |
| Титан | -0,033 | - |
| Вольфрам | -0,002 | - |
Из приведенных данных видно, что:
1. Полное отсутствие влияния кислорода на активность и растворимость азота как в жидком (при t=1600 °С), так и твердом (при t=1200 °С) железе;
2. Качественно одинаковый характер влияния легирующих и примесных элементов на растворимость азота в расплавленных и твердых сплавах железа;
3. Все нитридообразующе элементы повышают растворимость азота в расплавах на основе железа (т.е. имеют отрицательные значения 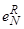 );
);
4. Углерод, кремний и фосфор понижают растворимость азота в расплавленном железе. По данным работы [163] при концентрациях углерода, приближающихся к составу цементита (Fe3C) растворимость азота, даже при температурах расплава около 2500°С, приближается к нулю;
5. Такие примесные элементы, как S, Cu, As, Sn, Sb также несколько понижают растворимость азота в расплавленном железе.
Применение параметров взаимодействия первого порядка обычно вполне достаточно для расчета растворимости азота в расплавах на основе железа. Лишь иногда – в случае высоколегированных сплавов – приходится пользоваться параметрами взаимодействия второго порядка:
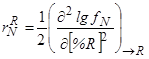 (143)
(143)
К сожалению, значения 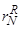 вычислены далеко не для всех интересующих металлургов компонентов сплавов железа.
вычислены далеко не для всех интересующих металлургов компонентов сплавов железа.
Термодинамические характеристики нитридообразования для большинства встречающихся в сталях компонентов подробно проанализированы в работе [160]. Из таблицы 12 видно, что при Т=1900 °К упругость диссоциации нитридов легирующих элементов несравненно выше соответствующей упругости диссоциации оксидов.
Таблица 12 – Параметры взаимодействия 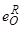 и
и 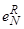 и упругости диссоциации оксидов и нитридов некоторых элементов при t=1900 К
и упругости диссоциации оксидов и нитридов некоторых элементов при t=1900 К
| Элемент | B | Al | Si | Ti | V | Cr | Zr | Nb | Ce |
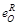
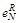
| – 0,13 | -1,0 0,006 | -0,131 0,065 | -5,0 -0,63 | -0,11 -0,10 | -0,041 -0,10 | – – | -0,14 -0,067 | – – |
| Оксид нитрид | B2O3 BN | Al2O3 AlN | SiO2 Si3N4 | Ti3O5 TiN | V2O3 VN | Cr2O3 CrN | ZrO2 ZrN | NbO2 NbN | CeO2 CeN |
| Оксид нитрид | 15,1 4,5 | 19,6 6,48 | 14,7 1,44 | 18,0 8,7 | 14,1 0,9 | 11,8 -1,42 | 20,4 10,4 | 12,75 – | 17,1 6,57 |
Это справедливо даже по отношению к церию и цирконию. Эти данные говорят о том, что нитриды даже "сильных" нитридообразующих элементов непрочны при температурах жидкого металла и позволяют предполагать образование нитридных неметаллических включений только при кристаллизации металла и при более низких температурах.
Дата добавления: 2016-11-26; просмотров: 1639;











