Гены, участвующие в канцерогенезе
В основе опухолевого роста всегда лежит повреждение генома клетки, вызываемое вирусами, физическими, химическими факторами или спонтанно. В настоящее время не подвергается сомнению генетическая теория канцерогенеза, согласно которой в основе малигнизации клетки лежит повреждение генома (клеточная мутация). Существуют и эпигеномные изменения клетки, способствующие развитию опухоли, что послужило основанием создания эпигеномной теории канцерогенеза, о которой пойдет речь ниже.
Повреждение генома клетки происходит по 3-м классам регулирующих генов:
а) стимулирующих рост - протоонкогенов,
б) ингибирующих рост - антионкогенов,
в) отвечающих за апоптоз.
а. Клеточные протоонкогены. При изучении вирусного канцерогенеза было обнаружено, что онковирусы при попадании в клетки вносят в ее геном гены, стимулирующие клеточную пролиферацию, а следовательно, способствующие малигнизации клеток. Эти гены были названы вирусными онкогенами. Цитогенетические исследования показали, что аналоги вирусных онкогенов имеются и в клетках человека и животных, где они выполняют различные функции регуляции синтетических процессов и деления. Более того, предполагается, что вирусы, несущие эти онкогены когда-то “украли” их из клеток хозяина. Поэтому, для более точного разделения, клеточные регулирующие гены - аналоги вирусных онкогенов были названы протоонкогенами, а в случае их чрезмерной экспрессии - клеточными онкогенами. Клеточные онкогены появляются при таких повреждениях генома клетки, когда происходит нарушение регуляции функции протоонкогенов, их нерегулируемая экспрессия и, соответственно синтез различных факторов (онкобелков), стимулирующих клеточную пролиферацию и деление. Клеточные онкогены влияют на различные процессы в клетках (рис. 2).
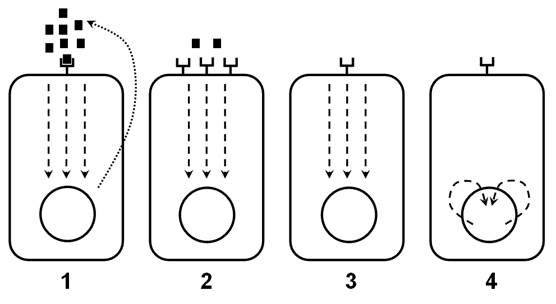
Рис. 2. Различные механизмы стимуляции клеточной пролиферации онкогенами.
1 - образование факторов роста.
2 - образование рецепторов к факторам роста, не требующих стимуляции этими факторами.
3 - стимуляция цитоплазматической передачи сигнала.
4 - образование ядерных белков - транскрипционных факторов.
Свои обозначения клеточные онкогены преимущественно получили от названия вируса, в составе которого были в свое время впервые обнаружены вирусные онкогены, идентичные клеточным, либо от вида опухоли, при которой были выявлены эти онкогены. Примеры часто встречающихся онкогенов у человека:
1. Онкогены, кодирующие факторы роста:
· sis в 22 паре хромосом (simian sarcoma virus). Кодирует тромбоцитарный фактор роста. Активация этого онкогена происходит при таких опухолях как астроцитома, остеосаркома и некоторые другие.
· hst-1 (human stomach cancers), int-2 (mammary tumors virus integration) - кодируют факторы роста фибробластов. Часто выявляются в геноме опухолевой клетки при раке желудка, молочной железы, меланомах.
2. Онкогены, кодирующие рецепторы к факторам роста - мембранным белкам с протеинкиназной активностью. Теория онкогенов предполагает выработку рецепторов с постоянной высокой активностью, т.е. не зависящих от стимуляции самим фактором роста.
· erb-B в 7 паре хромосом (avian erythroblastosis virus) - несколько онкогенов (В1, В2, В3). Кодируют синтез рецепторов к эпидермальному фактору роста. На здоровой клетке количество таких рецепторов 1,5×105, а при экспрессии этих онкогенов достигает до 70-90×105. Они обнаруживаются в клетках при плоскоклеточном раке легкого (erb-B1), раке молочной железы, желудка, легких, яичников (erb-B2, erb-B3).
· fms в 5 паре хромосом (feline McDonough sarcoma virus), кодирующий рецепторы к КСФ-М. Появляется при острых миелобластных лейкозах.
3. Онкогены, кодирующие передачу сигнала в клеточной цитоплазме.
а. Связанные с мембранными рецепторами и системой ГТФ и G-протеинов.
· ras (murine sarcoma virus) - группа онкогенов в различных хромосомах (6, 11, 12 парах хромосом). В норме уровень ГТФ, а следовательно и G-протеина ограничены активностью фермента ГТФ-азы, который в свою очередь регулируется ГТФ-азным активирующим протеином (GAP). Продукты ras - онкогенов являются белками, прочно связывающимися с GAP и таким образом угнетающими активность ГТФ-азы. Это приводит к тому, что в клетке повышается уровень ГТФ, а следовательно и G-протеина, что приводит к усиленной стимуляции пролиферации клеток. С этими онкогенами связано почти 30% всех опухолей легких, кишечника, поджелудочной железы, некоторые лейкозы. Очень часто химический канцерогенез связан с появлением именно ras-онкогенов.
б. Связанные с протеинкиназами, не зависящими от рецепторов на мембране клеток.
· abl (Abelson murine leukemia) в 9 паре хромосом, часто транслоцируется на 22 хромосому с одновременным нарушением регуляции. Наиболее часто активация этого онкогена выявляется при хроническом миелолейкозе, при котором типично образование BCR-ABL онкогена.
4. Ядерные протеины, участвующие в транскрипции и репликации ДНК.
· с-myc в 8 паре хромосом (avian myelocytomatosis virus) осуществляет активацию транскрипции ДНК, особенно усиление активности генов, стимулирующих рост (sis - онкогена). Выявляется при мелкоклеточном раке легких, лимфоме Беркитта и др.
б. Антионкогены или гены супрессии опухолей. Их функция хорошо прослеживается при изучении наследственных опухолей. Было обнаружено, что многие наследственные опухоли связаны с мутациями некоторых генов, что приводило к потере их функции и возникновению опухолей. Такие гены были названы антионкогенами или генами-супрессорами опухолевого роста. Свои названия антионкогены получили от заболевания, при котором они были впервые выявлены, либо по названию кодируемого ими белка. В настоящее время выявлен ряд различных антионкогенов; примеры некоторых из них:
· DCC - ген (deleted in colon carcinoma) в 18 паре хромосом, кодирующий белки, похожие на молекулы адгезии (кадгерины). При потере функции этого гена нарушаются межклеточные контакты и механизмы контактного торможения пролиферации. Кроме того, клетка становится более лабильной, приобретает возможность отрыва от соседних клеток (рис. 3). Данное нарушение наблюдается в 70% случаев рака толстой кишки.
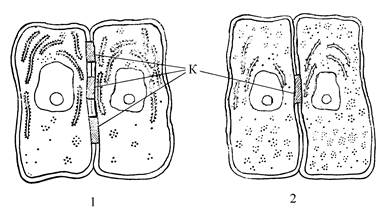
Рис. 3. 1 - нормальные межклеточные контакты (К); 2- уменьшенное количество межклеточных контактов, например при потере функции гена DCC.
· NF-1 (neurofibromatosis) в 17 паре хромосом, кодирует GAP. Потеря функции этого гена аналогична появлению ras-онкогена, поскольку приводит к чрезмерному увеличению содержания в клетке ГТФ и G протеина. Такой дефект встречается при некоторых опухолях нервной системы (невриномах).
· Rb1 (retinoblastoma) в 13 паре хромосом, кодирует одноименный белок, блокирующий репликацию ДНК в клетке и предотвращающий переход клетки из G1 в S фазу. Генеративная мутация Rb1 лежит в основе развития ретинобластомы.
· р53 в 17 паре хромосом, кодирует ядерный фосфопротеин – белок р53, регулирующий репликацию ДНК, пролиферацию клеток и программированную клеточную смерть (апоптоз). Сам белок р-53 очень быстро разрушается (за минуты). При повреждении клетки синтез белка р53 резко возрастает, он связывается с ДНК и предотвращает G1 фазу митотического цикла, что позволяет клетке успеть восстановить ДНК. При потере функции данного гена снижается способность к репарации ДНК в клетке (рис. 4). Это повреждение отмечается при многих опухолях: рак молочной железы, саркомы, рак кишечника и др. Кроме мутации функция гена р53 может быть подавлена и некоторыми вирусными белками (вирусом папилломы, аденовирусом). Потеря функции р53 встречается приблизительно в 50% опухолевых заболеваний у человека.
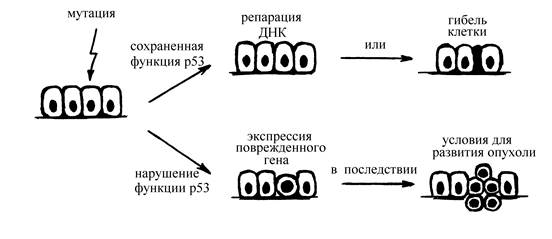
Рис. 4. Роль гена р53 в патогенезе нарушений клеточного роста.
· APC (adenomatous polyposis coli) в 5 паре хромосом. Генеративная мутация данного антионкогена лежит в основе развития семейного полипоза толстой кишки. Кодируемый геном APC белок подавляет активность β-катенина, который, в свою очередь, способствует сохранению фенотипа и пролиферативной способности стволовых клеток кишечника, находящихся на дне кишечных крипт. В связи с этим, уровень APC в стволовых клетках кишечных крипт невысок. Однако, в норме по мере продвижения дифференцирующихся энтероцитов к вершине кишечной ворсинки в них нарастает уровень АРС и снижается уровень β-катенина. Это приводит к прекращению деления энтероцитов и их гибели путем апоптоза после 3-4 дней функционирования. Мутация АРС приводит к сохранению пролиферативной активности выходящих из крипт транзиторных клеток, которые дают начало доброкачественным полипам. Следующая мутация, например, в онкогене Ras, приводит к их озлокачествлению.
· BRCA1 и BRCA2 (breast cancer) кодируют белки, участвующие в репарации ДНК. Особенно важной функций BRCA является репарация двунитевых разрывов в ДНК. При мутациях, нарушающих структуру и функцию BRCA, в клетке резко увеличивается вероятность возникновения вторичных онкогенных мутаций.
в. Гены, регулирующие апоптоз (программируемую смерть клеток). Одним из наиболее изученных в этом семействе является BCL- 2 - ген (B-cell leukemia). Белок-продукт этого гена входит в состав внутренней мембраны митохондрий и одновременно угнетает оксидативное повреждение клетки. Так, при чрезмерной экспрессии этого гена в опухолевой клетке замедляется естественное ее повреждение радикалами кислорода, что приводит к заметному удлинению срока жизни опухолевой клетки.
Необходимо отметить, что в опухолевой клетке имеется не единичное, а множественное нарушение генома и, как правило, происходит активация нескольких онкогенов и выключение функции нескольких антионкогенов (рис. 5). Поэтапное повреждение генома клетки приводит к ее постепенному озлокачествлению, что называется опухолевой прогрессией. Опухолевая прогрессия происходит при нарушении функции многих генов с различной локализацией в геноме. Последовательное повреждение генома может быть связано с длительным воздействием химических или других канцерогенных воздействий. При достижении опухолью определенных размеров и степени злокачественности она становится способной к метастазированию.
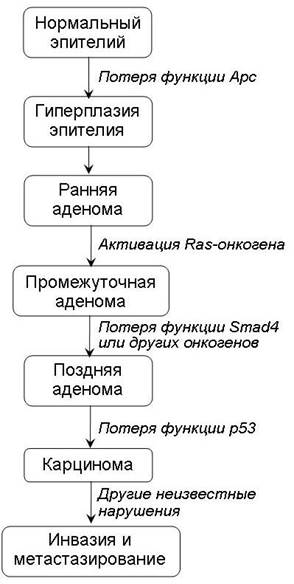
Рис. 5. Молекулярная модель патогенеза рака толстой кишки. Канцерогенез — многоступенчатый процесс, в ходе которого происходит выключение функции генов-супрессоров и активация онкогенов.
Дата добавления: 2016-11-04; просмотров: 4368;











