Основные характеристики подуровней
| Значение l | ||||
| Форма электронного облака | 
| 
| 
| 
|
| Подуровень | s | p | d | f |
| Число АО | ||||
| Графическая схема подуровня | 
| 
| 
| 
|
| Значения ml | –1, 0,+1 | –2,–1, 0,+1,+2 | –3,–2,–1, 0,+1,+2,+3 |
Электроны в атоме заполняют АО в соответствии со следующими принципами и правилами:
1. Принцип минимальной энергии: электроны в атоме стремятся занять в первую очередь те АО, которым соответствует наименьшее значение энергии электрона.

 2. Правило Хунда (Гунда): в пределах одного подуровня электроны располагаются так, чтобы их суммарный спин был максимальным. Это означает, что в первую очередь электроны заполняют все свободные АО подуровня по одному, имея при этом одинаково направленные спины (их называют параллельными) , а затем происходит заполнение этих АО вторыми (парными) электронами (их называют антипараллельными).
2. Правило Хунда (Гунда): в пределах одного подуровня электроны располагаются так, чтобы их суммарный спин был максимальным. Это означает, что в первую очередь электроны заполняют все свободные АО подуровня по одному, имея при этом одинаково направленные спины (их называют параллельными) , а затем происходит заполнение этих АО вторыми (парными) электронами (их называют антипараллельными).
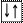 3. Принцип Паули: на одной АО может находиться не более двух электронов, отличающихся друг от друга значением ms ( ). Таким образом, максимальное число электронов на любом s-подуровне равно 2
3. Принцип Паули: на одной АО может находиться не более двух электронов, отличающихся друг от друга значением ms ( ). Таким образом, максимальное число электронов на любом s-подуровне равно 2 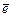 (в электронной формуле соответствует записи ns2), p-подуровне – 6
(в электронной формуле соответствует записи ns2), p-подуровне – 6 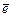 (np6), d-подуровне – 10
(np6), d-подуровне – 10 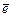 [(n – 1)d10], f-подуровне – 14
[(n – 1)d10], f-подуровне – 14 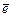 [(n – 2)f 14].
[(n – 2)f 14].
Общее число АО на энергетическом уровне определяется по формуле
NАО = n2 (6)
Общее число электронов на уровне можно вычислить по уравнению
Nе = 2n2 (7)
2. Правило Клечковского: с ростом атомного номера элемента электроны размещаются на АО последовательно по мере возрастания суммы (n + l); при одинаковых значениях этой суммы раньше заполняется АО с меньшим значением числа n.
Например: 4s-орбиталь заполняется электронами раньше, чем 3d, потому что сумма (n + l) для 4s равна (4 + 0) = 4, а для 3d равна (3 + 2) = 5.
По правилу Клечковского заполнение энергетических уровней в основном соответствует следующему ряду: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p и т.д.
У некоторых элементов ПС заполнение АО электронами происходит с нарушением правила Клечковского. Например: в соответствии с данным правилом электронная формула 29Cu должна заканчиваться …4s23d 9, а на самом деле она имеет вид …4s13d10. Таким образом, один электрон с внешнего 4s подуровня перешел («провалился») на внутренний 3d и завершил его формирование (число электронов достигло максимума – 10 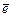 ). Этот и другие подобные факты связаны с тем, что полностью и наполовину заполненным подуровням соответствуют более выгодные с точки зрения энергии электронные конфигурации (они легче возникают и их сложнее разрушить).
). Этот и другие подобные факты связаны с тем, что полностью и наполовину заполненным подуровням соответствуют более выгодные с точки зрения энергии электронные конфигурации (они легче возникают и их сложнее разрушить).
При отрыве электронов от атома он превращается в положительно заряженный ион – катион, заряд которого равен числу отнятых электронов. Присоединение же электронов к атому приводит к образованию отрицательного иона – аниона, заряд которого равен количеству принятых электронов. При образовании катионов электроны в первую очередь покидают внешний энергетический уровень, а при образовании анионов размещаются на уровнях с соблюдением правила Клечковского.
Электроны внешнего энергетического уровня и отдельных подуровней второго (а для лантаноидов и актиноидов – третьего) от конца электронного слоя, на которых количество электронов не достигло максимального значения, называются валентными.
Элементы, в атомах которых валентными являются только s-орбитали, относятся к семейству s-элементов; элементы, в которых кроме s-орбиталей валентными являются также и p-орбитали, относятся к семейству p-элементов и т.д.
Дата добавления: 2016-11-04; просмотров: 1879;











