Развитие спектрального анализа
Спектральным анализом называется физический метод определения химического состава вещества, основанный на изучении спектра излучения или поглощения электромагнитных волн этим веществом. Различают качественный и количественный анализ. Задачей качественного спектрального анализа является установление всех химических элементов, из которых состоит исследуемый образец. Она решается путем измерения длин волн спектральных линий излучения вещества и отождествления их по таблицам с определенными химическими элементами.
В задачу количественного спектрального анализа входит определение концентраций химических элементов, содержащихся в веществе-источнике излучения. Этот анализ производится путем измерения интенсивностей спектральных линий данного элемента и последующего сравнения их с интенсивностями тех же линий в образцах с известной концентрацией того же элемента.
Спектральный анализ в подавляющем большинстве случаев точнее, быстрее и чувствительнее химических методов и поэтому широко применяется в современном производстве и в научных исследованиях. Особую роль играет спектральный анализ в астрофизике: здесь это единственный экспериментальный метод определения химического состава в строении звезд.
Путь к современным методам, технике и пониманию физических основ спектрального анализа был длинным и непростым. Началом систематического изучения спектров излучения вещества следует считать работы И. Ньютона по преломлению света в призмах. Он первым сформулировал идею о том, что белый свет является составным, т.е. представляет собой смесь лучей различного цвета и различной преломляемости.
В 1834 г. Ф. Тальбо первым пришел к заключению: “Когда в спектре пламени появляются какие-либо определенные линии, они характеризуют металл, содержащийся в пламени”. В 1835 г. Ч. Уитстон, исследуя спектр электрической искры, подтверждает эту мысль: линии спектра зависят только от качества электродов, причем для каждого материала характерен свой спектр.
В 1854-1859 г.г. физик Г.Р. Кирхгоф и химик Р.Б. Бунзен провели большую серию экспериментов со спектрами излучения различных веществ, возбуждаемых в пламени газовой горелки, и пришли к фундаментальному выводу: “Разнообразие соединений, в которые входили металлы, разнообразие химических процессов, происходивших в различных пламенях, и огромный интервал температур – все это не оказывает никакого влияния на положение спектральных линий отдельных металлов”. Тем самым были сформулированы основы спектрального анализа: однозначная связь вида спектра с химической индивидуальностью атомов данного элемента. Сейчас говорят так: спектры – это паспорта атомов.
Плодотворность спектральных методов не замедлила проявиться: стоило в спектре какого-то соединения обнаружить неизвестные ранее линии, как химическим путем из этого соединения извлекался новый элемент. Так были открыты: рубидий (1860 г.), цезий (1861 г.), таллий (1862 г.), индий (1863 г.), галлий (1875 г.), гелий (1895 г.).
Однако, несмотря на значительные успехи в практическом применении спектрального анализа, вплоть до начала XX века оставались неясными фундаментальные физические вопросы: как устроен атом; почему спектры излучения атомов состоит из отдельных узких линий, тогда как спектры излучения молекул представляет собой набор относительно широких полос; почему спектры всех элементов разные? Иными словами: каков механизм излучения и поглощения света веществом. Ответить на эти вопросы классическая физика не смогла.
Постулаты Бора
В 1913 г. Нильс Бор постулировал дискретность энергетических состояний атомов, откуда с необходимостью следует квантовый характер поглощения и излучения света.
Первый постулат Бора гласит: атом может находиться лишь в определенных дискретных энергетических состояниях, в которых он не излучает, несмотря на ускоренные движения входящих в его состав заряженных частиц. Такие состояния называются стационарными.
Согласно второму постулату атом излучает или поглощает энергию лишь при скачкообразном переходе из одного стационарного состояния в другое. При этом частота излученного или поглощенного кванта света пропорциональна разности энергии начального Е1и конечного Е2 состояний:
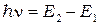 (1) Коэффициентом пропорциональности служит постоянная Планка h.
(1) Коэффициентом пропорциональности служит постоянная Планка h.
Постулаты Бора имеют чрезвычайно общий характер и применимы к любому атому или атомной системе. Их правильность многократно подтверждена экспериментально. Таким образом, теория Бора хорошо описывает физический механизм поглощения и излучения света.
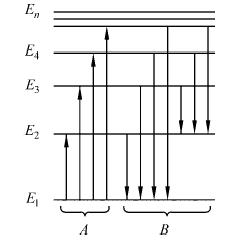
Рис. 1. Энергетические уровни атома и переходы между уровнями, сопровождаемые поглощением или излучением квантов света
Каждое стационарное состояние атома характеризуется определенной энергией Еn (n = 1,2,3,...∞). Поэтому принято говорить об энергетических уровнях данного атома и наглядно представлять их в виде схемы уровней энергии (рис.1).
На схеме по оси ординат откладываются дискретные значения энергии Еn стационарных состояний, а ось абсцисс не имеет никакой координаты. Горизонтальные прямые фиксированных значений Еn обозначают скачкообразные переходы электрона в атоме из одного стационарного состояния в другое. Стрелками вверх показано поглощение света. Стрелки вниз означают испускание кванта света с соответствующим уменьшением энергии атома. Частоты излучения и поглощения могут быть легко рассчитаны по формуле (1). Важно подчеркнуть, что спектральные переходы возможны строго между определенными уровнями энергии. Никаких промежуточных переходов в атоме быть не может. Следовательно, не может быть и квантов света с промежуточными значениями энергии, а значит и частоты  .
.
В современной квантовой механике строго доказано, что атомы каждого химического элемента имеют присущий только им набор возможных стационарных энергетических состояний. Переходы между этими состояниями и образуют спектр частот излучения (или поглощения), характерный только для данного элемента. Именно поэтому оказывается возможным отождествление химического элемента по его спектру испускания или поглощения, т.е. качественный спектральный анализ.
Число спектральных линий одинаковых атомов может быть очень велико. Например, спектр железа только в видимой и ультрафиолетовой областях содержит около 60 тысяч линий. У других многоэлектронных атомов число линий того же порядка. Следовательно, не исключено случайное совпадение некоторых частот в спектре различных атомов, что называется в спектроскопии “наложением” линий. Поэтому качественный спектральный анализ следует проводить по нескольким наиболее интенсивным линиям в исследуемом спектре. Совпадение измеренных длин волн этих линий с табличными данными надежно показывает присутствие элемента в источнике излучения.
Дата добавления: 2021-02-19; просмотров: 722;











