Спектр атома водорода
Экспериментальное исследование спектров излучения разрежённых газов (отдельных атомов), т.е. газов для которых взаимодействием между атомами можно пренебречь, показали, что характерный линейчатый спектр каждого элемента представляет собой серии линий, положение которых может быть описано простыми эмпирическими формулами. Так, например, положение линий излучения атома водорода в видимой области спектра для длин волн описываютсяформулой Бальмера:
 , (1.1)
, (1.1)
или используя соотношение 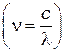 для частот
для частот
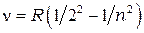
 = 3, 4, 5,…..
= 3, 4, 5,…..
где  = 1,1∙107 м-1,
= 1,1∙107 м-1, 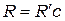 =3,29∙1015 c-1 - постоянная Ридберга
=3,29∙1015 c-1 - постоянная Ридберга
Позднее, в ультрафиолетовой области была обнаружена:
серия Лаймана 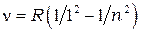
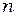 = 2, 3, 4, 5,… (1.2)
= 2, 3, 4, 5,… (1.2)
и в инфракрасной области
серия Пашена: 
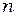 = 4, 5, 6,… (1.3)
= 4, 5, 6,… (1.3)
серия Брэкета: 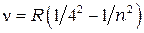
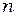 = 5, 6, 7,… (1.4)
= 5, 6, 7,… (1.4)
серия Пфунда: 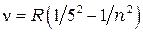
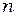 = 6, 7, 10,… (1.5)
= 6, 7, 10,… (1.5)
серия Хемфри: 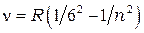
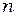 = 7, 10, 9,… (1.6)
= 7, 10, 9,… (1.6)
Все эти серии могут быть описаныобобщенной формулой Бальмера:
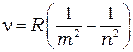 (1.7)
(1.7)
где 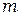 = 1,2,3,4,5,6 определяет серию,а
= 1,2,3,4,5,6 определяет серию,а 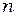 =
= 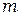 +1,
+1, 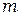 +2, определяет отдельные линии этой серии. С увеличением
+2, определяет отдельные линии этой серии. С увеличением 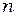 линии серии сближаются; значение
линии серии сближаются; значение 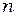 = ∞ определяетграницу серии, к которой со стороны больших частот примыкает сплошной спектр. Аналогичные серии были выделены в линейчатых спектрах других атомов.
= ∞ определяетграницу серии, к которой со стороны больших частот примыкает сплошной спектр. Аналогичные серии были выделены в линейчатых спектрах других атомов.
Постулаты Бора
Для объяснения закономерностей в линейчатых спектрах Бор объединил планетарную модель атома Резерфорда с гипотезой Планка о квантовой природе света. Теория атома Бора основывается на двух постулатах:
(1) Первый постулат (постулат стационарных состояний): существуют стационарные (не изменяющиеся со временем) состояния атома, находясь в которых он не излучает энергии.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь квантованные значения момента импульса, удовлетворяющие условию
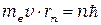 (
( 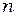 = 1, 2, 3, ) (2.1)
= 1, 2, 3, ) (2.1)
где me — масса электрона, и 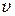 — его скорость на
— его скорость на 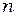 -й орбите радиуса
-й орбите радиуса  ,
, 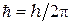 . Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Каждое стационарное состояние характеризуется определенным(дискретным) значением энергии. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Каждое стационарное состояние характеризуется определенным(дискретным) значением энергии. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
(2) Второй постулат (правило частот): при переходе атома из одного состояния в другое испускается или поглощается один фотон с энергией
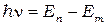 (2.2)
(2.2)
равной разности энергий соответствующих стационарных состояний.
Излучение фотона происходит при переходе атома из состояния с большей энергией в состояние с меньшей энергией ( 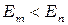 ), т.е. при переходе электрона с орбиты более удалённой от ядра на ближнюю к ядру орбиту.
), т.е. при переходе электрона с орбиты более удалённой от ядра на ближнюю к ядру орбиту.

Рис. 1.
Поглощение фотона сопровождается переходом атома в состояние с большей энергией ( 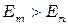 ), т.е. переходом электрона на более удалённую от ядра орбиту.
), т.е. переходом электрона на более удалённую от ядра орбиту.
Набор всевозможных дискретных частот квантовых переходов:
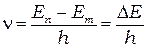
определяетлинейчатый спектр атомов (см. Приложение №1)
Дата добавления: 2021-02-19; просмотров: 394;











