Самопроизвольная кристаллизация
Самопроизвольная кристаллизация обусловлена стремлением вещества иметь более устойчивое состояние, характеризуемое уменьшением термодинамического потенциала G. С повышением температуры термодинамический потенциал вещества как в твердом, так и в жидком состоянии уменьшается, что показано на рис. 2.1.
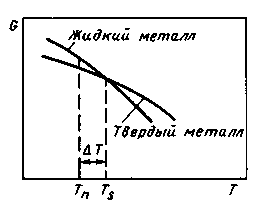
Рис. 2.1. Изменение термодинамического потенциала в зависимости от температуры для металла в твердом и жидком состояниях
Температура, при которой термодинамические потенциалы вещества в твердом и жидком состояниях равны, называется равновесной температурой кристаллизации. Кристаллизация происходит в том случае, если термодинамический потенциал вещества в твердом состоянии будет меньше термодинамического потенциала вещества в жидком состоянии, т. е. при охлаждении жидкого металла до температур ниже равновесной. Плавление - процесс, обратный кристаллизации, происходит при температуре выше равновесной, т. е. при перегреве. Разница между реальными температурами плавления и кристаллизации называется температурным гистерезисом.
Поскольку жидкий металл обладает большей внутренней энергией, чем твердый, то для расплавления требуется затратить теплоту, а при кристаллизации теплота выделяется. Между теплотой Q и температурой кристаллизации Тк существует взаимосвязь. Так, при равновесной температуре кристаллизации термодинамические потенциалы в жидком и твердом состояниях равны, т. е.
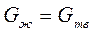 , (2.1)
, (2.1)
откуда согласно формуле (1.1) из главы 1 получим
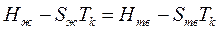 è
è 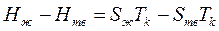
или
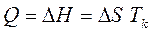 . (2.2)
. (2.2)
Изменение энтропии ΔS характеризует изменение упорядоченности расположения атомов при переходе из жидкого состояния в твердое. В зависимости от сил межатомной связи теплота кристаллизации для различных металлов изменяется от 2500 Дж/моль (Na, К и др.) до 20000 Дж/моль (W и др.). При кристаллизации отвод теплоты, происходящий вследствие теплопередачи, компенсируется выделением теплоты кристаллизации и температура расплава остается постоянной.
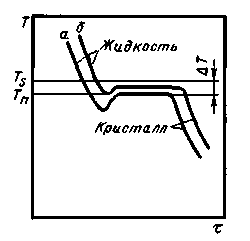
Рис. 2.2. Кривые охлаждения металла
В связи с этим на кривой охлаждения, изображаемой в координатах температура–время, процессу кристаллизации соответствует горизонтальный участок (рис. 2.2).
При большом объеме жидкого металла выделяющаяся при кристаллизации теплота повышает температуру практически до равновесной (кривая б); при малом объеме металла выделяющейся теплоты недостаточно, вследствие чего кристаллизация происходит с переохлаждением по сравнению с равновесной температурой (кривая а). Разница между равновесной (Ts) и реальной (Тn) температурой кристаллизации называется степенью переохлаждения ΔT.
Степень переохлаждения зависит также от природы металла, увеличивается с повышением чистоты металла и с ростом скорости охлаждения. Обычная степень переохлаждения металлов при кристаллизации в производственных условиях колеблется от 10 до 30 °С; при больших скоростях охлаждения она может достигать сотен градусов.
Степень перегрева при плавлении металлов, как правило, не превышает нескольких градусов.
В жидком состоянии атомы вещества вследствие теплового движения перемещаются беспорядочно. В то же время в жидкости имеются группировки атомов небольшого объема, в пределах которых расположение атомов вещества во многом аналогично их расположению в решетке кристалла. Эти группировки неустойчивы, они рассасываются и вновь появляются в жидкости. При переохлаждении жидкости некоторые из них, наиболее крупные, становятся устойчивыми и способными к росту. Эти устойчивые группировки атомов называют центрами кристаллизации (зародышами). Образованию зародышей способствуют флуктуации энергии, т. е. отклонения энергии группировок атомов в отдельных зонах жидкого металла от некоторого среднего значения. Размер образовавшегося зародыша зависит от величины зоны флуктуации.
Появление центров изменяет свободную термодинамическую энергию системы ΔW. С одной стороны, при переходе жидкости в кристаллическое состояние термодинамический потенциал уменьшается на ΔG , с другой стороны, общая энергия увеличивается, вследствие появления поверхности раздела между жидкостью и кристаллическим зародышем, на величину, равную Sσ :
|
 |
Рис. 2.3. Изменение термодинамической энергии ΔW
при образовании зародышей в зависимости от их размера
Если принять, что зародыш имеет форму куба с ребром а, то выразим объем и площадь поверхности куба
V=a3 ; S= 6 a2,
где V – объем зародыша; S – поверхность зародыша.
Отсюда найдем общее изменение термодинамической энергии:
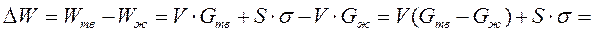
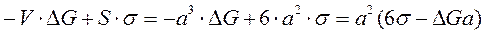 ,
,
где σ – удельное поверхностное натяжение на границе кристалл–жидкость; ΔG – разность термодинамических потенциалов жидкого и кристаллического состояний.
График зависимости изменения термодинамической энергии ΔW от размера зародыша (см. рис. 2.3) достигает максимума при некотором значении размера, которое называют критическим, а затем уменьшается. Оценим критический размер, приравняв нулю изменение термодинамического потенциала:
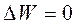 =>
=> 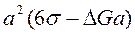 = 0 ,
= 0 ,
откуда
 . (2.3)
. (2.3)
Увеличение величины зародыша больше критического размера вызывает уменьшение энергии системы ΔW , и поэтому такие зародыши являются устойчивыми, способными к росту. Зародыши, имеющие размер меньше критического, нестабильны и растворяются в жидкости, поскольку их рост вызывал бы увеличение энергии ΔW.
Скорость процесса и окончательный размер кристаллов при затвердевании определяются соотношением скоростей роста кристаллов и образования центров кристаллизации. Скорость образования зародышей измеряется числом зародышей, образующихся в единицу времени в единице объема; скорость роста - увеличением линейного размера растущего кристалла в единицу времени. Оба процесса связаны с перемещениями атомов и зависят от температуры. Графическая зависимость скорости образования зародышей и скорости их роста от степени переохлаждения представлена на рис. 2.4.
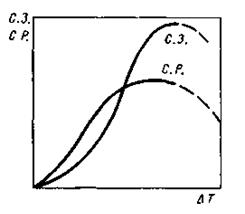
Рис. 2.4. Изменение скорости образования зародышей (с. з.) и скорости роста кристаллов (с. р.) в зависимости от степени переохлаждения DТ
Для металлов, которые в обычных условиях кристаллизации не склонны к большим переохлаждениям, как правило, характерны восходящие ветви кривых. Это значит, что при равновесной температуре, когда степень переохлаждения равна нулю, скорость образования зародышей и скорость роста также равны нулю, т. е. кристаллизации не происходит. При небольших степенях переохлаждения, когда велик зародыш критического размера, а скорость образования зародышей мала, при затвердевании формируется крупнокристаллическая структура. Небольшие степени переохлаждения достигаются при заливке жидкого металла в форму с низкой теплопроводностью (земляная, песчаная) или в подогретую металлическую форму. Увеличение переохлаждения происходит при заливке жидкого металла в холодные металлические формы, а также при уменьшении толщины стенок отливки. Поскольку при этом скорость образования зародышей увеличивается более интенсивно, чем скорость их роста, получаются более мелкие кристаллы.
Дата добавления: 2016-11-04; просмотров: 2681;











