Квантово-механическое рассмотрение химической связи.
Ковалентная связь
Получить ответ, удовлетворительно объясняющий природу и механизм химической связи, оказалось возможным только после появления квантово-механической теории строения атома, так как при образовании связи проявляются специфические для микрообъектов свойства электронов.
С точки зрения квантовой механики при образовании химической связи между атомами их электронные орбитали перекрываются. В результате в межъядерной области создается повышенная электронная плотность по сравнению с электронной плотностью в изолированных атомах, которая как бы стягивает ядра в единую устойчивую систему (рис.1, а). В силу особенностей электронных состояний между ядрами может происходить не повышение электронной плотности, а, наоборот, уменьшение ее до нуля. В этом случае химическая связь не образуется (рис. 1, б). Причины устойчивости многоатомной частицы заключаются в понижении энергии ее образования. Рассмотрим, например, изменение энергии при сближении двух атомов водорода, находящихся на бесконечно большом расстоянии (r = ∞) друг от друга. Потенциальную энергию Е при г = ∞ примем равной нулю.
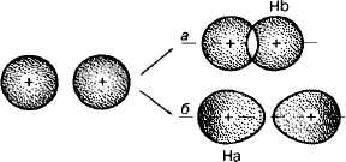
Рис.1 Взаимодействие между атомами водорода, приводящее к образованию связи (а) и не приводящее к образованию связи (б)
Система состоит из двух протонов и двух электронов. Между частицами возникает два типа сил: силы отталкивания между электронами двух атомов и протонами атомов и силы притяжения между протонами и электронами.
Если спины электронов антипараллельны, то при сближении атомов происходит уменьшение потенциальной энергии системы и при r= r0 силы притяжения становятся равными силам отталкивания, а энергия системы принимает свое минимальное значение. При дальнейшем сближении атомов силы отталкивания будут больше сил притяжения и потенциальная энергия системы начинает резко возрастать. Графическая зависимость потенциальной энергии системы из двух атомов водорода от межъядерного расстояния, называемая ПОТЕНЦИАЛЬНОЙ КРИВОЙ, представлена на рис.2.
Таким образом, при сближении двух атомов водорода с электронами, обладающими антипараллельными спинами, на расстояние r0 система имеет минимальную энергию и, следовательно, в этом случае образуется устойчивая химическая связь (рис. 2, а).
В случае, когда спины параллельны, квантово-механические расчеты по уравнению Шредингера показывают, что потенциальная энергия системы при любом расстоянии между сближающимися атомами больше, чем сумма энергий двух отдельных атомов и образование химической связи невозможно. Потенциальная кривая в данном случае выглядит иначе (рис. 2, б).
В заключение отметим, что в рамках этой модели ядро атома не закрепляется неподвижно в точке О, а постоянно колеблется. В реальной же двухъядерной молекуле колеблются оба ядра, достигая определенных предельных состояний. Молекулы все время как бы растягиваются и сжимаются. При этом го — среднее расстояние между ядрами, а Еmin — минимальная энергия молекулы с учетом колебания ядер.
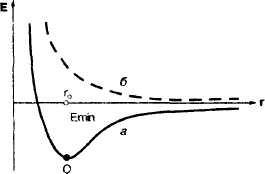
Рис 2. потенциальная кривая
Дата добавления: 2021-02-19; просмотров: 643;











