Электрофильное присоединение.
Ответ:
Алкены, алкадиены и алкины известны своей способностью легко реагировать с электрофильными реагентами, присоединяя их по кратным связям. В результате взаимодействия электрофильного агента Е+ с алкеном образуется карбокатион, обладающий высокой реакционной способностью. Карбокатион далее стабилизируется за счет быстрого присоединения нуклеофильного агента Nu–:
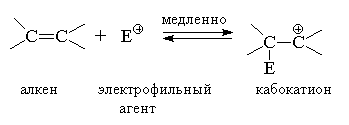
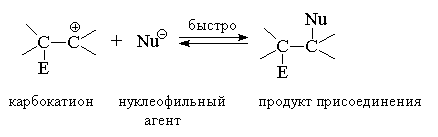
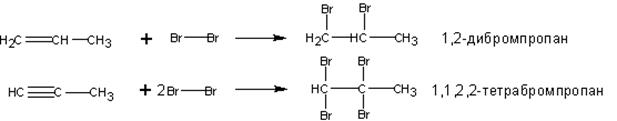
В случае, если присоединяется симметричный реагент (такой, как Br2), затруднений в определении продуктов реакции не возникает. При избытке реагента происходит насыщение кратных связей и превращение алкенов – в дигалогеналканы, алкинов – в тетрагалогеналканы:
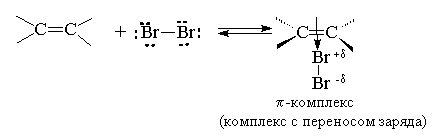
Присоединение брома и хлора к алкенам происходит по ионному, а не по радикальному механизму. Этот вывод следует из того, что скорость присоединения галогена не зависит от облучения, присутствия кислорода и других реагентов, инициирующих или ингибирующих радикальные процессы. На основании большого числа экспериментальных данных для этой реакции был предложен механизм, включающий несколько последовательных стадий. На первой стадии происходит поляризация молекулы галогена под действием электронов π-связи. Атом галогена, приобретающий некоторый дробный положительный заряд, образует с электронами π-связи нестабильный интермедиат, называемый π-комплексом или комплексом с переносом заряда. Следует отметить, что в π-комплексе галоген не образует направленной связи с каким-нибудь конкретным атомом углерода; в этом комплексе просто реализуется донорно-акцепторное взаимодействие электронной пары π-связи как донора и галогена как акцептора.
Далее π-комплекс превращается в циклический бромониевый ион. В процессе образования этого циклического катиона происходит гетеролитический разрыв связи Br-Br и пустая р-орбиталь sp2-гибридизованного атома углерода перекрывается с р-орбиталью "неподеленной пары" электронов атома галогена, образуя циклический ион бромония.
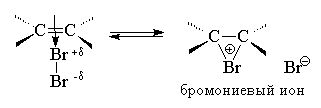
На последней, третьей стадии анион брома как нуклеофильный агент атакует один из атомов углерода бромониевого иона. Нуклеофильная атака бромид-иона приводит к раскрытию трехчленного цикла и образованию вицинального дибромида (vic-рядом). Эту стадию формально можно рассматривать как нуклеофильное замещение SN2 у атома углерода, где уходящей группой является Br+ .
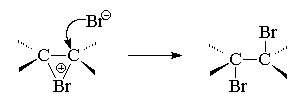
Присоединение галогенов к двойной связи алкенов представляет собой одну из формально простых модельных реакций, на примере которой можно рассмотреть влияние основных факторов, позволяющих сделать аргументированные выводы о детальном механизме процесса. Однако, когда присоединяется несимметричный реагент (а таких подавляющее большинство) к несимметричному же алкену (или замещенному алкену), предсказать строение продукта становится сложнее. В ряде случаев присоединение происходит по правилу Марковникова:
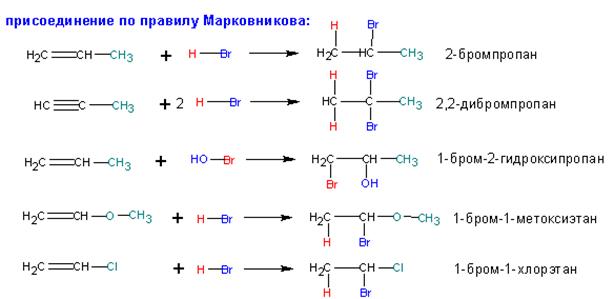
Это происходит, если один из заместителей (или оба) при углеродах с кратной связью является электронодонорным: алкил–, метокси–, галоген– и т.п.). Если заместитель электроноакцепторный (циано–, нитро–, сульфо–, карбокси–, карбонильная и т.п. группы), то присоединение протекает ПРОТИВ правила Марковникова:
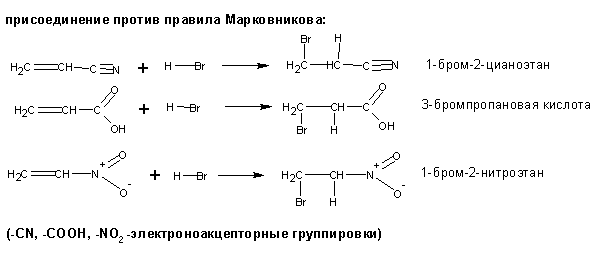
В таких случаях для предсказания состава продукта следует рассматривать интермедиаты реакции – карбкатионы, и решать вопрос об их относительной стабильности. Образование продуктов происходит через превращения с наиболее устойчивым промежуточным карбкатионом:
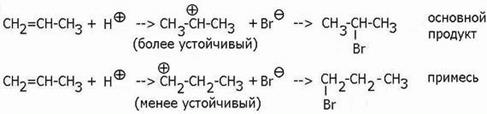
Вопрос о сравнительной устойчивости карбкатионов решается просто. “Чисто” алкильные карбкатионы увеличивают устойчивость в ряду:
первичные < вторичные < третичные < аллильные, бензильные
Чем больше алкильных заместителей у положительно заряженного углерода, тем карбкатион устойчивей, вследствие нарастания компенсирующего заряд +I эффекта алкильной группы. Соответственно, следует учитывать влияние электроноакцепторных групп, таких, как:
–СООН, –СN, –CX3 (X–галоген), –C(O)–R, –COOR, –NO2, –N=O, –SO3H и др.
Любая из этих группировок, во-первых, затрудняет реакцию электрофильного присоединения в целом (обеднение электронной плотности С=С связи и дестабилизация карбкатиона), и во-вторых, приводит к образованию продуктов ПРОТИВ правила Марковникова:
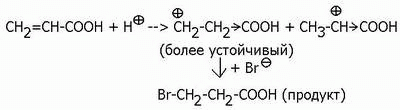
Однако, группировки, имеющие на атоме, связанном с положительно заряженным углеродом карбкатиона, неподеленную пару электронов, увеличивают стабильность катиона, и вызывают образование продуктов присоединения по правилу Марковникова. К таким группировкам относятся: –О–, –ОН, –ОR, –NH2, –NHR, –NR2, –X (галоген), –SH, –SR и некоторые другие:
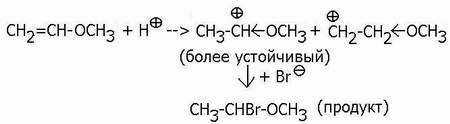
Схема компенсации положительного заряда мезомерным эффектом атома с неподеленной парой электронов выглядит так:
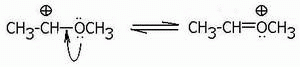
Несмотря на имеющийся у всех заместителей отрицательный индуктивный эффект –I (вследствие большей электроотрицательности), положительный мезомерный эффект (+M) в данном случае играет решающую роль.
Все сказанное относится к реакциям электрофильного присоединения. Следует помнить, однако, что присоединение HBr к алкенам, в зависимости от условий, может протекать как по механизму электрофильного присоединения, так и радикальным присоединением. Состав продуктов реакции полностью определяется механизмом ее протекания.
Радикальное присоединение к двойной связи С=С
. Перекисный эффект.
Наиболее изучено открытое Карашем в 1932 году радикальное присоединение бромистого водорода, инициируемое следами перекиси и ингибируемое гидрохиноном. Открытие механизма радикального присоединения к двойным связям положило конец противоречиям, наблюдаемым у многочисленных исследователей при присоединении бромистого водорода к несимметричным алкенам: у одних эта реакция приводила к продуктам присоединения против правила Марковникова, у других – по правилу Марковникова, у третьих получалась смесь продуктов. Всему виной оказалось то, что у разных исследователей реакции протекали в различных условиях (и, соответственно, по различным механизмам), что и приводило к неоднозначным продуктам. При проведении реакции в условиях, характерных для протекания цепных процессов (газовая фаза, в индифферентном растворителе при освещении, присутствие следов перекисей) в качестве интермедиатов образуются радикалы:
H–Br à 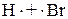 ,
,
либо: а) R–O–O–R à 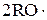 , б) H–Br +
, б) H–Br + 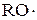 à R–OH +
à R–OH + 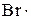
Далее протекает реакция с алкеном, причем алкен атакуется радикалом галогена:
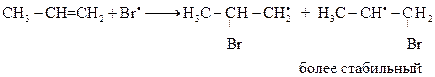
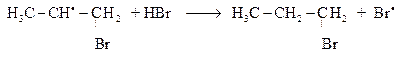
Дата добавления: 2016-11-04; просмотров: 3924;











