Определение и классификация коррозионных процессов. Химическая и электрохимическая коррозия
При эксплуатации изделий из металлов и их сплавов приходится сталкиваться с явлением разрушения их под действием внешней среды. Разрушение металлов и сплавов вследствие взаимодействия их с окружающей средой называется коррозией.
Коррозия металлов наносит большой экономический ущерб. В результате коррозии выходят из строя оборудование, машины, механизмы, разрушаются металлические конструкции. Особенно сильно подвёргается коррозии оборудованиё, которое контактирует с агрессивными средами, например, растворами кислот, солей.
Коррозионное разрушение может затрагивать всю поверхность металла - сплошная (общая) коррозия, или отдельные участки - местная (локальная) коррозия. В зависимости от механизма процесса различают химическую и электрохимическую химическую коррозию.
Химическая коррозия — это разрушение металла из-за окисления его окислителями, находящимися в коррозионной среде.
Химическая коррозия протекает без возникновения электрического тока в системе. Такой вид коррозии возникает при контакте металлов с неэлектролитами или в газовой среде при высоких температурах (газовая коррозия).
Газовая коррозия встречается довольно часто. С ней мы сталкиваемся при коррозии металлов в печах, выхлопных трубах и т.п. Наиболее опасными для металлов компонентами газовой среды являются кислород, пары воды, оксид углерода (IV), оксид серы (IV). Коррозионное разрушение железа и его сплавов на воздухе обусловлено окислением его кислородом воздуха.
С повышением температуры скорость газовой коррозии возрастает. Наибольший вред приносит электрохимическая коррозия.
Электрохимической коррозией называется разрушение металла при контакте с электролитами с возникновением в системе электрического тока.
Коррозия - это разрушение металлов в результате химической и электрохимической реакции.
Разрушение (порча), происходящие по физическим причинам не называются коррозией, а известно как эрозия или истирание или износ.
Термин "коррозия" относится только к химическому воздействию на металлы и не распространяется на неметаллические материалы. Пластмассы могут набухать, трескаться; дерево - расслаиваться или гнить.
Ржавление - коррозия железа и его сплавов с образованием продуктов коррозии, состоящих в основном из оксидов железа (гидратированных).
Цветные металлы, следовательно, корродируют, но не ржавеют.
Коррозионная наука.
Так как коррозия включает химическое превращение, для лучшего понимания коррозионных реакций необходимо знать основы химии и особенно электрохимии, так как коррозионные процессы по большой части являются электрохимическими.
Так как структура и состав металла зачастую определяют коррозионное поведение, надо быть знакомым с основами металлургии. Следовательно, химия и металлургия составляют фундамент при изучении коррозии, так же как биология и химия - при изучении медицины.
Коррозионная проблема.
Значение коррозионных исследований определяется тремя аспектами:
1 . Экономический.
Имеет целью уменьшение материальных потерь в результате коррозии трубопроводов, котлов, судов, мостов.
2. Повышение надежности оборудования.
Оборудование в результате коррозии разрушается с катастрофическими последствиями, например: сосуд высокого давления, паровые котлы, контейнера для токсичных материалов.
3. Сохранность металлического фонда.
Мировые ресурсы металла ограниченны, а потери в результате коррозии ведут к дополнительным затратам энергии и воды. И человеческий труд, затрачиваемый на проектирование и реконструкцию.
Причины коррозии металлов:
В природе все металлы (за исключением золота, серебра, металлов платиновой группы и в меньшей степени медь и ртуть) в основном встречаются в виде минералов, таких как сульфиды, силикаты, карбонаты. Для извлечения металла минерал необходимо подвергнуть реакции восстановления, используя в качестве восстановителя какое-либо вещество
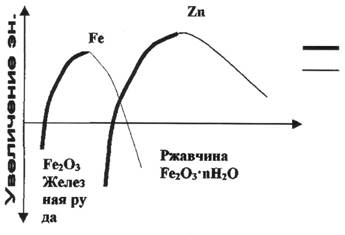 |
.
Химическое восстановление
Коррозия
Рис 1. Изменение во времени химической энергии при восстановлении оксидов в металлы и в ходе обратной реакции коррозии
2Fе2О3 + ЗС  4Fе + ЗСО2 (гематит)
4Fе + ЗСО2 (гематит)
2ZnО + С  2Zn + СО2
2Zn + СО2
Из графика (рис.1) видно, что металлический Zn энергетически менее стабилен, чем Fе и в атмосферных условиях имеет тенденцию превращаться в сложную смесь из гидроксида и основного карбоната и т.п. Однако, если ржавчина, образующаяся на стали представляет собой рыхлую массу, почти не защищает поверхность металла от проникновения Н2О и О2, то продукты коррозии Zn обладают существенными защитными свойствами, благодаря чему Zn коррозирует медленнее, чем Fе. По этой причине мягкие стали защищают Zn покрытием.
Типы коррозионных разрушений:
I. По характеру изменения поверхности металла или степени изменения физико-механических свойств.
Различают 5 основных типов коррозии:
1. Равномерная (общая или сплошная) - ржавление железа или потускнение серебра, высокотемпературное окисление металлов.
Скорость равномерной коррозии выражают в разных единицах мм/год или г/м2сутки. Например, сталь в морской воде коррозирует с постоянной скоростью ~ 0,13 мм/год, т.е. 2,5 г/м2сутки.
2. Местная коррозия - разрушение отдельных участков поверхности металла. Она имеет неодинаковую степень разрушения. Наиболее характерными видами местной коррозии являются коррозия в виде пятен, язв, точечная, межкристаллическая. Местная коррозия бывает трех типов:
а) точечная (питинг) - разрушает металл в виде отдельных точечных поражений, перерастающих в сквозные (коррозия нержавеющей стали в морской воде).
 |
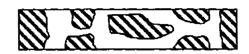 б) межкристаллическая коррозия (МКК) - это разрушение на границах зерен, приводящие к потери прочности и пластичности
б) межкристаллическая коррозия (МКК) - это разрушение на границах зерен, приводящие к потери прочности и пластичности
Межзеренное вещество, действующее как анод, контактирующее с большой поверхностью самих зерен, являющейся катодом. Коррозия протекает быстро, глубоко проникая в металл и приводя иногда к катастрофическим разрушениям. Нержавеющие стали или дюраль подвергнутые неправильной термообработке, склонны к (МКК) в зонах сварки.
в) транскристаллитная - рассекающая металл трещиной прямо через зерна. Растрескивание металла под действием периодических или растягивающих напряжений в коррозионной среде называют коррозионной усталостью.
3. Избирательная - коррозия, которой подвержены сплавы, содержащие несколько структурных составляющих.
4. Обесцинкование - это вид разрушения цинковых сплавов, например латуни, при котором преимущественно корродирует цинк, а медь остается на поверхности в виде пористого слоя. Прокорродировавшее, таким образом, изделие нередко сохраняет исходную форму и может показаться не поврежденными, но его прочность и особенно пластичность значительно снижены.
Подвергшаяся обесцинкованию латунная труба способна выдерживать внутреннее давление воды, однако разрушиться при гидравлическом ударе или проведении ремонтных работ.
5. Разрушение окисных пленок на поверхности металлов. При повреждении пленки А12Оз на алюминиевом изделии, находящемся в морской воде, возникает электролит 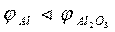 .
.
 |
Различные внутренние механические напряжения  напр. <
напр. <  ненапр. Поэтому в первую очередь будут растворяться напряженные участки металла. Внутренние напряжения в металлах существенно изменяются при сварочных работах. Уменьшить эти напряжения можно термообработкой изделия.
ненапр. Поэтому в первую очередь будут растворяться напряженные участки металла. Внутренние напряжения в металлах существенно изменяются при сварочных работах. Уменьшить эти напряжения можно термообработкой изделия.
II. По механизму реакции взаимодействия с окружающей средой различают:
1. Химическую.
2. Электрохимическую.
Особо выделяют биологическую коррозию идущую под влиянием продуктов жизнедеятельности бактерий и микроорганизмов и радиационную коррозию, протекающую под воздействием радиоактивного излучения.
Электрохимическая коррозия - это разрушение металлов и сплавов под действием жидкостей электролита. Электрохимическая коррозия осуществляется как гальванический процесс за счет разности электрохимических потенциалов различных частей изделия, если оно сделано из разных металлов или за счет разности потенциалов различных участков поверхности одного и того же металла, если он находится в различных концентрациях электролита.
В этом случае наряду с химическими процессами (отдача электронов) протекают и электрические (перенос электронов от одного участка к другому). При этом в результате взаимодействия металла с молекулами воды из коррозионной среды на нем протекают два процесса: окисление металла Ме (анодный процесс) и восстановление окислителей — компонентов среды (катодный процесс). Как правило, в качестве окислителей выступают ионы водорода (коррозия с водородной деполяризацией) или растворенный в воде кислород (коррозия с кислородной деполяризацией). В первом случае при катодном процессе выделяется водород, а во втором образуются гидроксид ионы. Участки поверхности металла, на которых протекают процессы окисления и восстановления, называют соответственно, анодными и катодными. Далее рассмотрим условия, при которых возможно протекание электрохимической коррозии.
Условия возникновения электрохимической коррозии:
1. Контакт двух металлов в электролите.
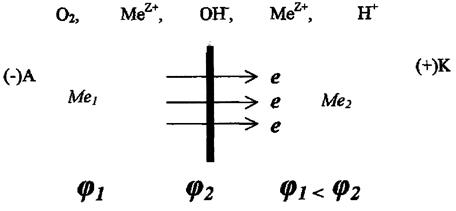 |
А: Ме1° - 2е  Ме
Ме 
К: 1) 2Н++ 2е  Н2, если рН < 7 (среда кислая)
Н2, если рН < 7 (среда кислая)
2) О2 + 2Н2О + 4е  4ОН
4ОН 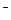 (среда нейтральная)
(среда нейтральная)
При контакте двух разнородных металлов образуется гальванопара в которой разрушается более активный металл. Наибольшая коррозия вблизи места контакта и по мере удаления ослабевает. При этом большую роль играет электропроводность среды. Интенсивность коррозии зависит от разности потенциалов между металлами более активный разрушается тем быстрее, чем больше разность потенциалов контактирующих металлов. Большое влияние оказывает соотношение площадей контактирующих поверхностей. Это связано с тем, что V коррозии определяется не только силой тока, но и плотностью тока (i) i=I/S. Поэтому опасно такое сочетание металла, при котором анод имеет малую площадь, а катод большую (Sан< Sкат). В этом случае анод малой площадью корродирует очень интенсивно.
Для разработки мероприятий по защите конструкций от контактной коррозии необходимо руководствоваться ГОСТ 9.005-92 "Машины, приборы и другие технические изделия. Допустимые и недопустимые контакты металлов"
При выборе металла должны учитывать:
1. Потенциал, площадь поверхности;
2. Между деталями из разнородных металлов нужно использовать, где это возможно изолирующие прокладки, мастики, герметики;
3. На контакт сопрягаемых деталей следует наносить изолирующее покрытие.
Анод: Fе° - 2е  Fе2+
Fе2+
Катод: О2 + 4е + 2Н2О  4ОН
4ОН 
2Fе + О2 + 2Н20  2Fе(ОН)2
2Fе(ОН)2
4Fе(ОН)2 + О2 + 2Н2О  4Fе(ОН)3
4Fе(ОН)3
ржавчина Fе(ОН)2 Fе(ОН)3 FеООН 
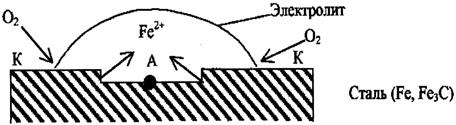
2. Различная аэрация (омывание газами).
То есть это различный доступ кислорода к одной и той же детали, такая коррозия встречается по ватерлинии судов.
 |
А: Fе° - 2е  FеC
FеC
К: О2 + 4е + 2Н2О  4ОН
4ОН 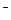
В центре капли, куда доступ кислорода мал, разрушается сам металл (становится эта часть поверхности анодом). По периферии, где проникновение О2 будет большим, он адсорбируется на поверхности металла и защищает его от действия электролита.
Вещества, принимающие на катоде электроны, называются деполяризаторами (вещества уменьшающие поляризацию) т.е. в данном случае кислород является деполяризатором. Наличие деполяризаторов усиливает коррозию. В качестве деполяризаторов могут быть и ионы водорода, которые при этом восстанавливаются. Поэтому понижение рН (подкисление) усиливает процесс коррозии.
3. Неоднородность поверхности металла.
Неоднородность поверхности металла возникает в результате:
а) повреждения оксидной пленки при изгибе, прессовании.
А: А1 - Зе  А1
А1 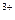 А: Fе - 2е
А: Fе - 2е  Fе2+(кислая среда)
Fе2+(кислая среда)
К: 2Н++ 2е  Н
Н 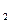 К: 2Н++ 2е
К: 2Н++ 2е  Н
Н 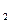
Коррозия с водородной деполяризацией, наличие деполяризатора для коррозии вредно. Оксидная пленка разрушается еще ионами NО3-, SО4 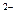 , Сl
, Сl 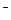 -ионы активаторы.
-ионы активаторы.
(-)А1 | Морская вода, О2 | А12О3 (+)
(-)А: А1 - Зе  А1
А1 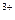
(+)К: О2 + 2Н2О + 4е  4ОН
4ОН 
4А1 + ЗО2 + 6Н2О  4А1(ОН)3
4А1(ОН)3
б) Неоднородность металлов и сплавов.
Рассмотрим, контакт двух форм стали, цементита (Fе3С) со
значительным содержанием углерода и перлита с меньшим содержанием углерода. В связи с тем, что потенциал перлита меньше потенциала цементита, в образовавшемся гальваническом элементе протекают реакции. Содержание углерода может уменьшаться в около шовной зоне после сварки.
(-)перлит | морская вода | цементит (+)
(+) анод Fе° - 2е 
катод О2 + 4е + 2Н2О  4ОН
4ОН 
2Fе + О2 + 2Н2О  2Fе(ОН)2
2Fе(ОН)2
в) Неоднородная обработка металла.
Плохо обработанная поверхность металла – анод, хорошо обработанная - катод. Поэтому, изделия находящиеся в агрессивных средах, должны иметь одинаковую обработку поверхности.
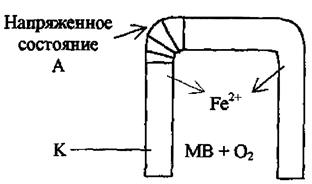
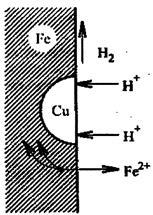 Электрохимическая коррозия может быть усилена, если металл содержит примеси других веществ или неметаллические включения. Например, железо загрязнено примесями меди. При этом возникают гальванические микроэлементы (пары), схема действия которой показана на рис. Металл с более отрицательным потенциалом разрушается — ионы его переходят в раствор, а электроны переходят к менее активному металлу, на котором происходит восстановление ионов водорода (водородная деполяризация) или восстановление растворенного в воде кислорода (кислородная деполяризация) (рис.2).
Электрохимическая коррозия может быть усилена, если металл содержит примеси других веществ или неметаллические включения. Например, железо загрязнено примесями меди. При этом возникают гальванические микроэлементы (пары), схема действия которой показана на рис. Металл с более отрицательным потенциалом разрушается — ионы его переходят в раствор, а электроны переходят к менее активному металлу, на котором происходит восстановление ионов водорода (водородная деполяризация) или восстановление растворенного в воде кислорода (кислородная деполяризация) (рис.2).
|
Таким образом, при электрохимической коррозии (как в случае контакта разнородных металлов, так и случае образования микрогальванических элементов на поверхности одного металла) поток электронов направлен от более активного металла к менее активному (проводнику), и более активный металл корродирует. Скорость коррозии тем больше, чем дальше расположены друг от друга в ряду стандартных электродных потенциалов те металлы, из которых образовался гальванический элемент (гальваническая пара).
На скорость коррозии влияет и характер раствора электролита. Чем выше его кислотность (т. е. меньше рН), а также чем больше содержание в нем окислителей, тем быстрее протекает коррозия. Значительно возрастает коррозия с ростом температуры.
Некоторые металлы при соприкосновении с кислородом воздуха или в агрессивной среде переходят в пассивное состояние, при котором резко замедляется коррозия. Например, концентрированная азотная кислота легко делает пассивным железо, и оно практически не реагирует с концентрированной азотной кислотой. В таких случаях на поверхности металла образуется плотная защитная оксидная пленка, которая препятствует контакту металла со средой. Переход металла в пассивное состояние чаще объясняется образованием на его поверхности хемосорбированного слоя атомов кислорода. При этом атомы кислорода могут покрывать как всю поверхность металла, так и часть ее. Пассивации благоприятствуют легирование более легко пассивирующимся металлом, увеличение концентрации пассиваторов около поверхности металла и другие факторы.
Защитная пленка всегда имеется на поверхности алюминия. Подобные пленки в сухом воздухе образуются также на Ве, Сг, Zn, Та, Ni, Сu и других металлах. Кислород является наиболее распространенным пассиватором.
Пассивированием объясняется коррозионная стойкость нержавеющих сталей и сплавов.
В первую очередь будут растворяться напряженные участки металла.
Внутренние напряжения в металлах существенно изменяются при сварочных работах. Уменьшить эти напряжения можно термообработкой изделия.
Дата добавления: 2016-10-26; просмотров: 2135;











