ПРОИЗВОДСТВО МЕТАНОЛА И ПРОДУКТОВ НА ЕГО ОСНОВЕ
Производство метанола.Долгое время, вплоть до 30-х гг. прошлого столетия единственным промышленным методом производства метанола являлась сухая перегонка древесины. Поэтому очень часто до сих пор метанол называют древесным спиртом, хотя получают из древесины не более 0,1 % от общего объема производства метанола.
В настоящее время практически единственным промышленным методом производства метанола является его получение из синтез-газа по реакции:
СО + 2Н2®СН3ОН.
Условия проведения этого процесса определяются в основном каталитической системой. При использовании катализаторов на основе оксидов цинка и хрома процесс протекает при температуре около 400 °С и давлении до 35 МПа; более современные катализаторы на основе оксида меди позволяют проводить процесс в значительно более мягких условиях - температуре около 250 °С и давлении до 5 МПа.
При производстве метанола из природного газа (через синтез-газ) теряется около 40% энергии по сравнению с прямым использованием природного газа в качестве моторного топлива, что является существенным недостатком этого направления использования природного газа как моторного топлива [7].
Значительное внимание уделяется процессу получения метанола прямым окислением метана:
СН4 + 0,502®СН3ОН,
что значительно выгоднее синтеза метанола из синтез-газа при условии высоких значений конверсии и селективности процесса прямого окисления. Однако в настоящее время не удается реализовать эти условия, и далее опытно-промышленных установок процесс прямого окисления не продвинулся.
Появились сообщения о том, что компания Catalyti-са Inc. (США) получила метанол прямым окислением метана на комплексном платиновом катализаторе с выходом метанола 70% против 43% с использованием ранее разработанного ртутного катализатора (при прямом газофазном процессе окисления метана выход метанола не превышает 5%). Реакция протекает при 220 °С и 3,3 МПа в жидкой фазе. Промышленная реализация планируется через 5 лет. Аналогично может быть осуществлено окисление этана в этанол и бензола в фенол.
Производство метанола в мире в настоящее время достигло уровня около 30 млн т в год, в РФ вырабатывается около 2 млн т.
Метанол относится к числу наиболее токсичных .веществ - прием внутрь даже 30 мл метанола приводит к летальному исходу, меньшие количества могут привести к слепоте и тяжелому отравлению. ПДК паров метанола в воздухе составляет 100 мг/м3.
В 2002 г. около 34% метанола перерабатывалось в формальдегид, на основе которого получают различные химические продукты, в том числе полимеры; на производство метил-третбутилового эфира (МТБЭ) расходовалось около 26% выработанного метанола; в качестве растворителя - 3%; компонента моторного топлива - 2%; на прочие цели (производство диметилтерефталата, метилметакрилата и т.п.) - 26%.
Применение метанола в качестве моторного топлива или добавки к углеводородным топливам рассматривается в разделе 2.1.
На основе метанола вырабатываются различные кислородсодержащие продукты - простые эфиры, которые широко применяются в качестве высокооктановых добавок к автомобильным бензинам; в последние годы значительное внимание уделяется производству из метанола простого эфира - диметилового, который некоторые ученые считают дизельным топливом XXI в.
Производство простых эфиров.Простые эфиры, полученные на основе метанола, обладают высокими антидетонационными свойствами, что позволяет их использовать в качестве высокооктановых добавок к автомобильным бензинам.
Первым из таких эфиров начали применять метил-третбутиловый эфир(МТБЭ), затем метил-третамиловый эфир(МТАЭ) и другие, получение которых протекает по реакциям:
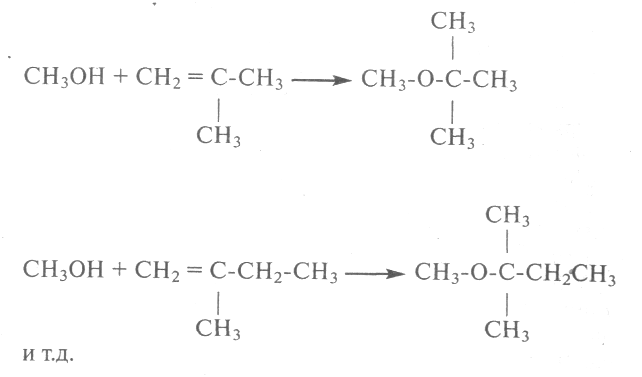
Получение этих продуктов протекает при температуре около 100 °С и небольшом избыточном давлении до 5 МПа в присутствии катализаторов (серной кислоты или более современном - ионообменных смол).
Первая промышленная установка по производству МТБЭ была пущена в Италии в 1973 г. и в настоящее время объем производства МТБЭ в мире превышает 25 млн т в год, при этом в США вырабатывается около 60 % мирового производства МТБЭ. В России производство МТБЭ находится на уровне 500-600 тыс. т при мощности установок порядка 1 млн т: 50-60 %-ная загрузка мощностей обусловлена отсутствием достаточных количеств изобутилена.
В основе существующего процесса промышленного синтеза диметилового эфира(ДМЭ) лежит экзотермическая реакция дегидратации метанола:
2СН3ОН®СН3ОСН3 + Н20.
Процесс протекает при температуре 300-400 °С, давлении около 1 МПа в присутствии катализатора - оксида алюминия. Мировое производство ДМЭ этим методом находится на уровне 150 тыс. т в год и ДМЭ применяется в основном в качестве пропелента взамен различных фторорганических продуктов.
Эта технология не может быть рекомендована для установок большой мощности, предназначенных для производства десятков миллионов тонн ДМЭ как дизельного топлива, т.к. его себестоимость вдвое выше себестоимости метанола.
Поэтому в настоящее время разработаны и реализуются в промышленном масштабе установки по прямому синтезу ДМЭ из синтез-газа, когда наряду с метанолом в реакторе образуется ДМЭ и далее необходима стадия разделения этих продуктов. Учитывая значительную разницу в температурах кипения метанола и ДМЭ (56 °С и минус 25,3 °С соответственно), проведение этой стадии осуществляется достаточно просто ректификацией или, что лучше, последовательной конденсацией. Для реализации такого метода производства ДМЭ необходим бифункциональный катализатор, позволяющий осуществлять получение метанола из синтез-газа с одновременной его дегидратацией в ДМЭ.
ДМЭ как дизельное топливо обладает высоким цетановым числом (таблица 25, стр. 100), практическим отсутствием токсичных веществ в отработавших газах и низкой температурой застывания (около минус 138 °С), что особенно важно для климатических условий России и существующем дефиците низкозастывающих дизельных топлив. Последнее обстоятельство позволит, вероятно, использовать ДМЭ не только как таковой, но и как компонент дизельного топлива.
Недостатками ДМЭ как дизельного топлива являются его низкая температура кипения (около минус 25 °С) и неудовлетворительные противоизносные свойства - худшие из всех дизельных топлив. Эти свойства ДМЭ требуют решения определенных проблем, связанных с его хранением на АЗС и на борту автомобиля, а также системой подачи топлива в камеру сгорания.
Переработка метанола в бензин.Компанией «Mobile Oil» (США) был разработан процесс производства бензина из метанола, и в Новой Зеландии была построена установка мощностью 570 тыс. т целевого продукта в год. Процесс протекает при температуре около 400 °С и давлении до 2 M Па на цеолитном катализаторе ZSM-5 по схеме:
СН3ОН®смесь углеводородов + Н2О.
Из одной тонны метанола получают 390 кг бензиновой фракции 47-170 °С, 23,4 кг пропан-бутановой фракции, 20,6 кг сухого газа и 560 кг воды. Бензиновая фракция имеет октановое число около 87 по моторному и 96 по исследовательскому методу, содержание ароматических углеводородов до 60 % при содержании бензола менее 1 %. Недостатками этого бензина являются высокое содержание ароматических углеводородов, которое не укладывается в современные требования к автомобильным бензинам по этому показателю, а также высокое содержание ароматического углеводорода дурола -1,2,4,5 - тетраметилбен*зола, имеющего температуру плавления около 80 °С, что оказывает отрицательное влияние на низкотемпературные свойства бензина.
Эти недостатки привели к тому, что в настоящее время компания вынуждена была прекратить производство бензина по этому процессу и перевести установку на производство метанола.
При условии разработки катализатора, который обеспечит в составе бензина преимущественное содержание изопарафинов, Mobil-процесс может быть конкурентоспособным с процессом Фишера-Тропша, т.к. по расчетам стоимость бензина, полученного этими процессами, составляет 300-350 и 330-370 долл. за тонну соответственно.
Дата добавления: 2021-01-26; просмотров: 762;











