Глава III Производство стали
СУЩНОСТЬ ПРОЦЕССА
Сталь является основным видом металла, применяемым для создания современной техники. Это объясняется тем, что сталь обладает высокими прочностью и износостойкостью, хорошо сохраняет приданную форму в изделиях, сравнительно легко поддается различным видам обработки. Кроме того, основной компонент стали - железо - является широко распространенным элементом в земной коре.
Сущностью любого металлургического передела чугуна в сталь является снижение содержания углерода и примесей путем их избирательного окисления и перевода в шлак и газы в процессе плавки.
Основными материалами для производства стали являются передельный чугун и стальной лом (скрап). Содержание углерода и примесей в стали значительно ниже, чем в чугуне (табл. 2.1).
В процессе плавки стали происходит взаимодействие между металлической, шлаковой и газовой фазами и футеровкой плавильного агрегата, различными по агрегатному состоянию и химическому составу. В результате этого взаимодействия осуществляется переход химических элементов из одной фазы в другую. Обменные процессы сопровождаются химическими превращениями, главным образом на границе металлической фазы со шлаком. Металлическая фаза состоит из расплава химических элементов, шлаковая - из расплава оксидов и их соединений. Поэтому переход элемента из одной фазы в другую возможен только при протекании химической реакции образования или восстановления оксида. Так как примеси по своим физико-химическим свойствам различны, то для их удаления в плавильном агрегате создают определенные условия, используя основные законы физической химии.
В соответствии с законом действующих масс скорость химических реакций пропорциональна концентрации реагирующих веществ. Поскольку в наибольшем количестве в чугуне содержится железо, то оно окисляется в первую очередь при взаимодействии чугуна с кислородом в сталеплавильной печи:
Fe + 1/2О2 = FeO + Q кДж. (1)
Одновременно с железом окисляются Si, P, С, Мn и др.
Образующийся оксид железа при высоких температурах отдает свой кислород более активным элементам - примесям в чугуне, окисляя их:
2FeO + Si = SiO2 + 2Fe + Q1 кДж; (2)
5FeO + 2P = P2O5 + 5Fe + Q2 кДж; (3)
FeO + Mn = MnO + Fe + Q3 кДж; (4)
FeO + С = CO + Fe - Q4 кДж. (5)
Чем больше оксида железа содержится в жидком металле, тем активнее окисляются примеси. Для ускорения окисления примесей в сталеплавильную ванну добавляют железную руду, окалину, содержащие много оксидов железа. Таким образом, основное количество примесей окисляется за счет кислорода оксида железа.
Таблица 2.1.
Состав передельного чугуна и низкоуглеродистой стали, %
| Материал | С | Si | Мn | Р | S |
| Передельный чугун | 4. ..4,4 | 0,56... 1,26 | До 1,75 | 0,10... 0,3 | 0,03... 0,07 |
| Сталь низкоуглеродистая | 0,12... 0,25 | 0,12... 0,3 | 0,3... 0,9 | 0,05 | 0,050 |
Скорость окисления примесей зависит не только от их концентрации, но и от температуры металла и подчиняется принципу Ле Шателье, в соответствии с которым химические реакции, выделяющие теплоту, протекают интенсивнее при более низких температурах или при некотором понижении температуры, а реакции, поглощающие теплоту, протекают активнее при высоких температурах или при некотором повышении температуры. Поэтому в начале плавки, когда температура металла невысока, интенсивнее идут процессы окисления кремния, фосфора, марганца, протекающие с выделением теплоты, а углерод интенсивно окисляется только при высокой температуре металла (в середине и конце плавки).
После расплавления шихты в сталеплавильной печи образуются две несмешивающиеся среды: жидкий металл и шлак. Шлак представляет собой сплав оксидов с незначительным содержанием сульфидов. Образование шлака связано с окислением элементов металлической фазы во время плавки и образованием различных оксидов с меньшей плотностью, чем металл, собирающихся на его поверхности. В соответствии с законом распределения (закон Нернста), если какое-либо вещество растворяется в двух соприкасающихся, но несмешивающихся жидкостях, то распределение вещества между этими жидкостями происходит до установления определенного соотношения (константы распределения), постоянного для данной температуры. Поэтому большинство компонентов (Mn, Si, P, S) и их соединения, растворимые в жидком металле и шлаке, будут распределяться между металлом и шлаком в определенном соотношении, характерном для данной температуры.
Нерастворимые соединения в зависимости от плотности будут переходить либо в шлак, либо в металл. Изменяя состав шлака, можно менять соотношение между количеством примесей в металле и шлаке так, что нежелательные примеси будут удаляться из металла в шлак. Убирая шлак с поверхности металла и наводя новый путем подачи флюса требуемого состава, можно удалять вредные примеси (серу, фосфор) из металла. Поэтому регулирование состава шлака с помощью флюсов является одним из основных путей управления металлургическими процессами.
Используя изложенные законы, процессы выплавки стали осуществляют в несколько этапов.
Первый этап- расплавление шихты и нагрев ванны жидкого металла. На этом этапе температура металла невысока; интенсивно происходят окисление железа, образование оксида железа и окисление примесей Si, P, Мn по реакциям (1) - (4). Наиболее важная задача этого процесса - удаление фосфора (одной из вредных примесей в стали). Для этого необходимо проведение плавки в основной печи, в которой можно использовать основной шлак, содержащий СаО. Такой шлак должен обладать высокой основностью, т.е. способностью поглощать из металла и удерживать фосфор и серу. Основность (B) обычно определяют отношением концентрации основных и кислых оксидов:
В = (% СаО)/(% SiO2)
или
В = (% СаО)/(% SiO2 + Р2О5).
Основность шлака регулируется в соответствии с температурой, и в конце мартеновской плавки она составляет 2,7 ... 3 и 3 ... 4 в кислородно-конвертерном процессе. Выделяющийся по реакции (3) фосфорный ангидрид образует с оксидом железа нестойкое соединение (FeO)3 · Р2О5. Оксид кальция СаО - более сильное основание, чем оксид железа, поэтому при невысоких температурах связывает ангидрид P2O5, переводя его в шлак:
2[Р] + 5(FeO) + 4(CaO) ↔ (4СаО · P2O5)+5[Fe]. (6)1
1 Принято компонент, находящийся в растворе металла, обозначать в прямых скобках [Р], а находящийся в растворе шлака - в круглых скобках (СаО).
Реакция образования фосфорного ангидрида протекает с выделением теплоты, поэтому в соответствии с принципом Ле Шателье для удаления фосфора из металла необходимы невысокие температуры ванны металла и шлака. Из реакций (3) и (6) следует также, что для удаления фосфора из металла необходимо достаточное содержание в шлаке FeO, т.е. шлак должен обладать высокой окислительной способностью - передавать кислород металлу, находящемуся с ним в контакте. Окислительная способность шлака определяется активностью содержащихся в нем оксидов железа (главным образом FeO). Так, шлаки с высоким содержанием оксидов железа передают кислород металлу, а с низким - способны извлекать его. Для повышения содержания FeO в шлаке в сталеплавильную ванну в этот период плавки добавляют окалину, железную руду, наводя железистый шлак. По мере удаления фосфора из металла в шлак содержание фосфора в шлаке возрастает. В соответствии с законом распределения удаление фосфора из металла замедляется. Поэтому для более полного удаления фосфора из металла с его зеркала убирают шлак, содержащий фосфор, и наводят новый со свежими добавками СаО.
Второй этап - "кипение" металлической ванны - начинается по мере ее прогрева до более высоких, чем на первом этапе, температур. При повышении температуры металла в соответствии с принципом Ле Шателье более интенсивно протекает реакция (5) окисления углерода, происходящая с поглощением теплоты. Поскольку в металле содержится больше углерода, чем других примесей (см. табл. 2.1), то в соответствии с законом действующих масс для окисления углерода в металл вводят незначительное количество руды, окалины или вдувают кислород.
Образующийся в металле оксид железа реагирует с углеродом по реакции (5), а пузырьки оксида углерода СО выделяются из жидкого металла, вызывая "кипение" ванны. При "кипении" уменьшается содержание углерода в металле до требуемого, выравнивается температура по объему ванны, частично удаляются неметаллические включения, прилипающие к всплывающим пузырькам СО, а также газы, проникающие в пузырьки СО. Все это способствует повышению качества металла. Поэтому этап "кипения" ванны является основным в процессе выплавки стали.
В этот же период создаются условия для удаления серы из металла. Сера в стали находится в виде сульфида [FeS], который растворяется также в основном шлаке (FeS). Чем выше температура, тем большее количество FeS растворяется в шлаке, т.е. больше серы переходит из металла в шлак. Сульфид железа, растворенный в шлаке, взаимодействует с оксидом кальция, также растворенным в шлаке:
(FeS) + (СаО) = (CaS) + (FeO). (7)
Эта же реакция протекает на границе металл - шлак между сульфидом железа в стали [FeS] и (СаО) в шлаке:
[FeS] + (СаО) = (CaS) + (FeO). (8)
Образующееся соединение (CaS) растворимо в шлаке, но не растворяется в железе, поэтому сера удаляется в шлак.
Как следует из реакций (7) и (8), чем больше в шлаке (СаО) и меньше (FeO), тем полнее удаляется из стали сера. Поэтому при плавке в основных печах можно снизить содержание углерода и серы в стали, выплавлять сталь из шихты любого химического состава.
В сталеплавильных печах с кислой футеровкой нет условий для уменьшения количества фосфора и серы в стали, так как использовать основной шлак с высоким содержанием (СаО) нельзя из-за разрушения футеровки, а содержание (FeO) в шлаке недостаточно. Поэтому в кислых печах можно выплавлять сталь только из шихтовых материалов с малым количеством серы и фосфора.
Третий этап(завершающий) - раскисление стали - заключается в восстановлении оксида железа, растворенного в жидком металле. При плавке повышение содержания кислорода в металле необходимо для окисления примесей, но в готовой стали кислород - вредная примесь, так как понижает механические свойства стали, особенно при высоких температурах. Сталь раскисляют двумя способами: осаждающим и диффузионным.
Осаждающее раскисление осуществляют введением в жидкую сталь растворимых раскислителей (ферромарганца, ферросилиция, алюминия), содержащих элементы Mn, Si, A1 и др., которые в данных условиях обладают большим сродством к кислороду, чем железо. В результате раскисления восстанавливается железо и образуются оксиды MnO, SiO2, A12O3 и другие, которые имеют меньшую плотность, чем сталь, и удаляются в шлак. Однако часть их может остаться в стали, что понижает ее свойства.
Диффузионное раскисление осуществляют раскислением шлака. Ферромарганец, ферросилиций и другие раскислители в мелкоразмельченном виде загружают на поверхность шлака. Раскислители, восстанавливая оксид железа, уменьшают его содержание в шлаке. В соответствии с законом распределения оксид железа, растворенный в стали, начнет переходить в шлак. Образующиеся при таком способе раскисления оксиды остаются в шлаке, а восстановленное железо переходит в сталь, что уменьшает содержание в ней неметаллических включений и повышает ее качество.
При выплавке в кислой печи процесс плавки протекает при кислом шлаке (55 ... 58 % SiO2). Количество FeO и МnО в шлаке уменьшается в результате восстановления этих оксидов. Активность FeO в кислых шлаках значительно ниже, чем в основных, и окислительное действие их слабее, т.е. создаются благоприятные условия для раскисления стали, а именно: кремнезем, обладающий сильными кислотными свойствами, связывает FeO в соединение типа FeO · SiO2. После длительной выдержки под кислым шлаком содержание оксида железа в стали резко уменьшается, и окончательно сталь раскисляют небольшой добавкой ферромарганца.
В зависимости от степени раскисленности выплавляют спокойные, кипящие и полуспокойные стали.
Спокойная сталь получается при полном раскислении в печи и ковше.
Кипящая сталь раскислена в печи неполностью. Ее раскисление продолжается в изложнице при затвердевании слитка благодаря взаимодействию FeO и углерода, содержащихся в металле. Образующийся при реакции FeO + С = Fe + CO оксид углерода выделяется из стали, способствуя удалению из стали азота и водорода. Газы выделяются в виде пузырьков, вызывая ее "кипение". Кипящая сталь не содержит неметаллических включений - продуктов раскисления, поэтому обладает хорошей пластичностью.
Полуспокойная сталь имеет промежуточную раскисленность между спокойной и кипящей. Частично она раскисляется в печи и в ковше, а частично в изложнице благодаря взаимодействию оксида железа и углерода, содержащихся в стали.
Легирование стали осуществляют введением ферросплавов или чистых металлов в необходимом количестве в расплав. Легирующие элементы (Ni, Co, Мо, Си), сродство к кислороду у которых меньше, чем у железа, при плавке и разливке практически не окисляются, и поэтому их вводят в печь в любое время плавки (обычно вместе с остальной шихтой). Легирующие элементы, у которых сродство к кислороду больше, чем у железа (Si, Mn, Al, Cr, V, Ti и др.), вводят в металл после раскисления или одновременно с ним в конце плавки, а иногда непосредственно в ковш.
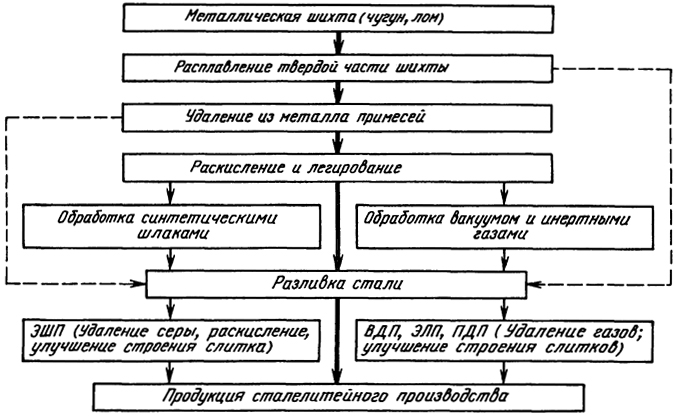
Рис. 2.2. Схема технологических процессов производства стали
Дата добавления: 2016-10-07; просмотров: 3181;











