ПРОМЫШЛЕННАЯ ВОДОПОДГОТОВКА
Промышленная водоподготовка представляет собой комплекс операций, обеспечивающих очистку воды — удаление из нее вредных примесей, находящихся в молекулярно-растворенном, коллоидном взвешенном состоянии. Основные операции водоподготовки: очистка от взвешенных примесей отстаиванием и фильтрованием, умягчение, а в отдельных случаях — обессоливание, нейтрализация, дегазация и обеззараживание.
Отстаивание воды проводят в непрерывно действующих отстойных бетонированных резервуарах. Для достижения полного осветления и обесцвечивания декантируемую из отстойников воду подвергают коагуляции.
Коагуляция — высокоэффективный процесс разделения гетерогенных систем, в частности выделения из воды коллоидно-дисперсных частиц глины, кварцевого песка, карбонатных и других пород, а также веществ органического происхождения, например белков. Суть процесса коагуляции сводится к введению в обрабатываемую воду коагулянтов, обычно различных электролитов. Ион-коагулянт, имеющий заряд, противоположный заряду коллоидной частицы, адсорбируется на поверхности. При этом нейтрализуется заряд частицы и сжимаются сольватные (гидратные) оболочки вокруг коллоидных частиц, которые могут объединяться друг с другом и седиментировать. Минимальная концентрация электролита, вызывающая за определенный промежуток времени явную коагуляцию, называется порогом коагуляции. Чем выше заряд иона-коагулянта, тем меньше порог коагуляции. Так, природные глинистые коллоидно-дисперсные системы имеют отрицательный заряд и для их коагуляции используют соединения алюминия в виде сульфата или двойных солей — квасцов. Одновременно с коагуляцией происходит процесс адсорбции коагулятом (осадком) различных органических красящих веществ, в результате чего вода обесцвечивается.
Часто, особенно когда в воде находятся не коллоидно-дисперсные вещества, а тонкодисперсные взвеси (т. е. более грубые по размерам частицы), которые, как правило, имеют очень слабый заряд, для водоподготовки используют процесс флокуляции. Вещества, вызывающие флокуляцию, называют флокулянтами.Флокулянты представляют собой растворимые в воде высокомолекулярные соединения (карбоксиметилцеллюлоза — КМЦ; полиакриламид — ПАА; полиоксиэтилен — ПОЭ; крахмал и др.). Они образуют мостиковые соединения между отдельными частицами дисперсной фазы, после чего эти тяжелые агрегаты седиментируют. Флокуляция происходит обычно очень быстро, а расход флокулянтов весьма незначительный; это делает рентабельным использование такого процесса, несмотря на достаточно высокую стоимость флокулянтов. Образующийся при коагуляции или флокуляции осадок удаляется из воды отстаиванием или фильтрованием.

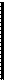
 Фильтрование — наиболее универсальный метод разделения неоднородных систем. В технике фильтрования наибольшее значение имеет развитая поверхность фильтрующего материала.
Фильтрование — наиболее универсальный метод разделения неоднородных систем. В технике фильтрования наибольшее значение имеет развитая поверхность фильтрующего материала.
Умягчение и обессоливание воды состоит в удалении солей кальция, магния и других металлов. В промышленности применяют различные методы умягчения, сущность которых заключается в связывании ионов Са2+ и Mg2+ реагентами в нерастворимые и легко удаляемые соединения. По применяемым реагентам различают способы: известковый (гашеная известь), содовый (кальцинированная сода), натронный (гидроксид натрия) и фосфатный (тринатрийфосфат). Наиболее экономично применение комбинированного способа умягчения, обеспечивающего устранение временной и постоянной жесткости, а также связывание СО2, удаление ионов железа, коагулирование органических и других примесей. Одним из таких способов является известково-содовый в сочетании с фосфатным. Процесс умягчения основывается на следующих реакциях:
1. Обработка гашеной известью для устранения временной
жесткости, удаления ионов железа и связывания СО2:
Са (НСОз)2 + Са (ОН)2 = 2СаСО3¯ + 2Н2О
Mg (НСО3)2 + 2Са (ОН)2 = 2СаСО3¯ + Mg (ОН)2 ¯+ 2Н2О
FeSO4 + Са (ОН)2 = Fe (OH)2¯. + CaSO4¯
4Fe (ОН)2 + О2 + 2Н2О = 4Fe (ОН)3¯
СО2 + Са (ОН)2 = CaCO3¯ + Н2О
2. Обработка кальцинированной содой для устранения постоянной жесткости:
Mg2+, Ca2+ + CO32– = MgCO3¯ , CaCO3¯
3. Обработка тринатрийфосфатом для более полного осаждения катионов Са2+ и Mg2+:
ЗСа(НСО3)2 + 2Nа3РО4 = Са3 (РО4)2¯ + 6NaHCO3
3MgCl2 + 2Na3PO4 = Mg3(РО4)2¯ + 6NaCl
Растворимость фосфатов кальция и магния ничтожно мала; это обеспечивает высокую эффективность фосфатного метода.
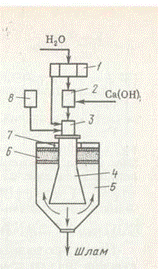
На рис. 1 представлена схема известково-содового способа умягчения воды. Вода через водораспределитель подается в сатуратор 2, куда добавляется гашеная известь, и затем в смеситель 3. В смеситель 1 из дозатора 8 поступает раствор соды, и поток очищаемой воды с реагентами идет в коническую трубу — реакционную камеру 4. Из реакционной камеры вода попадает в отстойник 5, где происходит отделение нерастворимого осадка — шлама, который удаляется из нижней части отстойника. Умягченная вода проходит фильтр 6, расположенный в верхней части отстойника, и через кольцевой желоб 7 отводится в сборные резервуары, а затем поступает на производство.
Значительный экономический эффект дает сочетание химического метода умягчения с физико-химическим, т. е. ионообменным способом. Сущность ионообменного способа умягчения состоит в удалении из воды ионов кальция и магния при помощи ионитов, способных обменивать свои ионы на ионы, содержащиеся в воде. Различают процессы катионного и анионного обмена; соответственно иониты называют катионитами и анионитами.
В основе катионного процесса умягчения лежит реакция обмена ионов натрия и водорода катионитов на ионы Са2+ и Mg2+. Обмен ионов натрия называется Na-катионированием, а ионов водорода — Н-катионированием:
Nа2 [Кат] + Са (НСО3)2 D Са [Кат] + 2NaHCO3
Na2 [Кат] + MgSO4 D Mg [Кат] + Na2SO4
H2 [Кат] + MgCI2 DMg [Кат] + 2НС1
H[Кат] + NaCl D Na[Кат] + НС1
Реакции ионообмена обратимы, и для восстановления обменной способности ионитов проводят процесс регенерации. Регенерацию Na-катионитов осуществляют при помощи растворов поваренной соли, а Н-катионитов — введением растворов минеральных кислот.
Примером анионного обмена может служить реакция обмена анионов ОН– по уравнению [Ан] ОН + НС1 D [Ан] С1 + Н2О
Регенерацию анионита проводят при помощи растворов щелочей:
[ Ан] Cl + NaOH D [Ан] ОН + NaCI
| |
| |
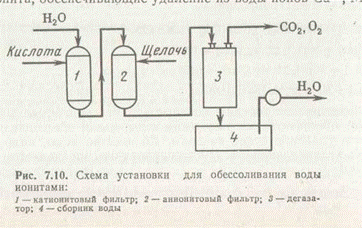

На рис. 2 представлена схема обессоливания воды с применением ионообмена (катионирование и анионирование). Вода равномерно подается в Н-катионитовый фильтр, где на слое крупного кварцевого песка расположены зерна катионита, обеспечивающие удаление из воды ионов Са2+, Mg2+, Na+, NH4+ и др. Затем вода поступает в анионитовый фильтр для связывания анионов и далее в дегазатор, где происходит выделение растворенных в воде СО2, О2. Полное обессоливание воды может быть достигнуто также путем ее перегонки — дистилляции — на перегонных установках.
Повышение технико-экономического эффекта водоподготовки связано с применением комбинирования нескольких технологических процессов, например коагуляции, умягчения и осветления с помощью современных методов ионного обмена, сорбции, электрокоагуляции и др.
Для современной промышленной водоподготовки значительный интерес представляет возможность применения электрохимических методов, в частности электрокоагуляции. Электрокоагуляция — способ очистки воды в электролизерах с растворимыми электродами — основана на электрохимическом получении гидроксида алюминия, обладающего высокой сорбционной способностью по отношению к вредным примесям. Перенос электричества при внесении электродов в воду и пропускании тока осуществляют в основном ионы, находящиеся в природной воде (Са2+, Mg2+, Na+, С1–, НСО3–, SO42– и др.). Степень участия ионов в переносе тока характеризуется их относительной концентрацией и подвижностью.
На растворимом алюминиевом аноде происходят два процесса — анодное и химическое (не связанное с протеканием электрического тока) растворение алюминия с последующим образованиемА1(ОН)3:
А1 — Зе– = Аl3+
А13+ +ЗОН– = А1(ОН)3
На катоде происходит выделение пузырьков газа — водорода (водородная поляризация), поднимающих частицы веществ на поверхность воды.
К достоинствам метода электрокоагуляции относятся: высокая сорбционная способность электрохимического А1(ОН)3, возможность механизации и автоматизации процесса, малые габариты очистных сооружений.
Для очистки главным образом кислых оборотных вод применяется нейтрализация — обработка воды оксидом или гидроксидом кальция.
Важной частью водоподготовки является удаление из воды растворенных агрессивных газов (СО2, О2) с целью уменьшения коррозии. Удаление газов осуществляют методом десорбции (термической деаэрации) путем нагревания паром. Термическую деаэрацию проводят в аппаратах, называемых деаэраторами (вакуумные, атмосферные, повышенного давления).
Воду, используемую для бытовых нужд, обязательно подвергают обеззараживанию — уничтожению болезнетворных бактерий и окислению органических примесей, в основном хлорированием при помощи газообразного хлора, а также хлорной извести и гипохлорита кальция.
Дата добавления: 2016-09-26; просмотров: 3108;











