Электрохимические производства
Электрохимические процессы основаны на взаимных превращениях химической энергии в электрическую и электрической в химическую. Электрохимическая промышленность, базирующаяся на электрохимических процессах, — одна из крупнейших отраслей народного хозяйства.
Быстрое развитие электрохимии и внедрение электрохимических процессов в различные отрасли промышленности происходит благодаря большим преимуществам электрохимических методом по сравнению, например, с химическими. В электрохимических производствах аппаратура проще во многих случаях и компактнее, уменьшается число производственных стадий и операций, дешевле сырье и выше полнота его использования; получение ценных товарных побочных продуктов уменьшает себестоимость основных. Одно из главных достоинств электрохимических методов — высокая чистота получаемых продуктов. Основной недостаток электрохимических производств — большой расход электроэнергии, который составляет главную долю себестоимости продуктов.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ЭЛЕКТРОЛИЗА ВОДНЫХ РАСТВОРОВ И РАСПЛАВЛЕННЫХ СРЕД
При электролизе химические реакции происходят в электролите — водном растворе или расплаве под влиянием постоянного электрического тока. В некоторых случаях применяется переменный ток (получение диоксида марганца на платиновых электродах) или наложение переменного тока на постоянный с целью усиления полезного действия постоянного тока (электрорафинирование металлов). Химическая сущность электролиза заключается в окислительно-восстановительных реакциях: на аноде анионы отдают электроны, т. е. окисляются, а на катоде катионы принимают электроны, т. е. восстанавливаются. Если электролиз ведут с растворимым металлическим анодом, то равновесие восстанавливается путем перехода в раствор катионов металла анода (рафинирование металлов).
В электролите обычно присутствует несколько типов ионов, из которых на электроде разряжается тот, который имеет минимальный электродный потенциал; в результате на электродах получают чистые вещества.
На практике порядок выделения продуктов электролиза на электродах определяется не только значениями их стандартных электродных потенциалов, но и условиями электролиза: материалом электрода и состоянием его поверхности, концентрацией электролита, интенсивностью его перемешивания, температурой и др. Подбором технологических условий электролиза можно изменить очередность разряда ионов и добиться достаточно высокой селективности процесса. С этой целью используют, например, явление поляризации (перенапряжения) на некоторых электродах. Поляризация электродов — отклонение электродного потенциала от стандартного (нормального) значения в реальных условиях электролиза. Скорость электрохимического процесса определяется скоростью наиболее медленной его стадии. При лимитирующей стадии массопереноса поляризация называется концентрационной. Если лимитирует стадия разряд-ионизация, то поляризация называется перенапряжением и определяется материалом электрода, состоянием его поверхности, плотностью тока, температурой, составом раствора.
Легкие металлы (литий, калий, натрий, магний, алюминий), а также некоторые тяжелые металлы, например свинец, нельзя получать электролизом водных растворов, так как они более электроотрицательны, чем водород; при электролизе водных растворов солей этих металлов на катоде выделяется водород. Металлы, электродный потенциал которых электроотрицателен, получают электролизом сред, не содержащих водорода, т. е. расплавленных солей, оксидов или гидроксидов металлов. Электролиз расплавленных сред основан на тех же закономерностях, что и электролиз водных растворов, но имеет характерные особенности и отличия, определяемые иными условиями, прежде всего высокими температурами — до 1400°С.
ЭЛЕКТРОЛИЗ ВОДЫ
Электролиз воды — хорошо разработанный и освоенный в промышленности способ производства водорода. Пока этот способ применяется в сравнительно небольших масштабах из-за большого расхода электроэнергии и электролитический водород по себестоимости еще не может конкурировать с полученным конверсионными методами. При электролизе воды кроме водорода, выделяющегося на катоде, в качестве ценного побочного продукта на аноде выделяется кислород, применяемый в металлургии, химической промышленности и в других отраслях народного хозяйства. Электролитическое разложение воды проводят в присутствии фонового электролита — кислот, щелочей или солей, так как электрическая проводимость воды весьма мала. Для производства водорода электролиз проводят в водных растворах щелочей — NaOH или КОН, менее агрессивных по отношению к конструкционным материалам электродов и электролизных ванн, чем кислоты (хотя электрическая проводимость кислот выше). Материалом для катодов служит сталь; иногда для снижения перенапряжения водорода на стальной катод наносят покрытие из никеля, содержащего серу. Анод изготовляется также из стали с никелевым покрытием для защиты от коррозии.
В стандартных условиях теоретическое напряжение разложения воды согласно составляет 1,23 В. Фактическое напряжение, прилагаемое к электролизеру при электролизе воды, много выше вследствие поляризации электродов и составляет 2,3—2,5 В.
Для снижения перенапряжения водорода и кислорода на электродах, а также для уменьшения удельного сопротивления электролита электролиз щелочных растворов проводят при повышенных температурах. Зависимость удельного сопротивления щелочного электролита от температуры показана на рис. 1.
| |
| |
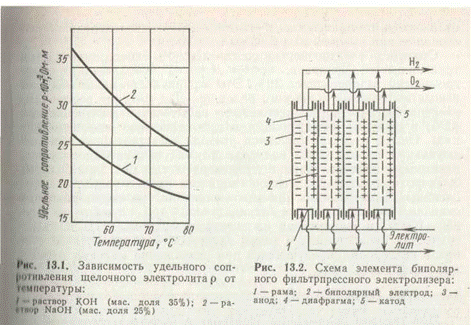
При температурах выше 100°С удельное сопротивление электролита и, следовательно, напряжение на электролизере возрастает из-за увеличения газонаполнения электролита. При высоких температурах электролиз проводят под давлением, снижающим газонаполнение электролита и поляризацию электродов. Применение давления 1—3 МПа позволяет проводить электролиз воды при температуре около 120°С.
Схема биполярного электролизера представлена на рис. 2. Ячейка состоит из двух стальных биполярных электродов и стальной никелированной рамы, к которой крепится пористая диафрагма, разделяющая внутреннюю полость ячейки на анодное и катодное пространства для раздельного выделения катодного (водород) и анодного (кислород) продуктов. К сплошным биполярным электродам крепятся выносные перфорированные электроды с целью развития электродной поверхности, на которой идут электрохимические реакции. В качестве пористой диафрагмы используют асбестовую ткань, армированную никелевой проволокой. Соединенные последовательно ячейки представляют собой биполярную конструкцию, в которой все промежуточные электроды работают, с одной стороны, как анод, а с другой — как катод, а крайние электроды работают монополярно; к крайним монополярным электродам подведен постоянный электрический ток. Электролит циркулирует между электролизером и сепараторами, в которых газообразные продукты электролиза отделяются от жидкости. Водород и кислород, выделенные в сепараторах, присоединяют к основным газовым потокам, выходящим из электролизера в сборные каналы, а электролит возвращают в электролизер. Фильтрпрессные электролизерыотличаются компактностью и минимальным межэлектродным расстоянием при высокой их производительности.
Стоимость электроэнергии составляет 90% себестоимости электролитического водорода, причем степень использования электроэнергии не превышает 30%. Это ограничивает масштабы производства электролитического водорода.
Для получения водорода предложены различные термоэлектрохимические процессы (циклы).
Сернокислотный цикл включает две стадии:
 1) электролиз раствора серной кислоты с выделением на катоде водорода и окислением на аноде диоксида серы согласно суммарной реакции
1) электролиз раствора серной кислоты с выделением на катоде водорода и окислением на аноде диоксида серы согласно суммарной реакции
SO2 + 2H2O ® H2SO4 + H2
2) термическое разложение серной кислоты, полученной на стадии электролиза, с образованием диоксида серы (900°С)
H2SO4 ® SO2 + Н2О + 1/2O2
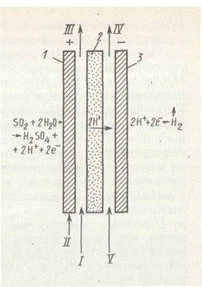
На рис. 3 приведена схема электрохимической стадии комбинированной системы. Диоксид серы подают во внутреннюю полость пористого анода, через поры которого SO2 диффундирует на поверхность и окисляется на ней. Образовавшиеся ионы водорода мигрируют, проходят через пористую диафрагму в катодное пространство и восстанавливаются на катоде, образуя газообразный водород. Серная кислота циркулирует в системе. В электролизере катод выполнен из нержавеющей стали, устойчивой по отношению к серной кислоте. Анодом служит полый внутри, пористый графитовый блок.
При крупномасштабном производстве электролитического водорода в
каскаде соединенных последовательно электролизеров в качестве побочного продукта получают тяжелую воду путем постепенного концентрирования тяжелой воды в электролизерах и ее извлечения методом изотопного обмена.
Дата добавления: 2016-09-26; просмотров: 5716;











