Сернокислотное вскрытие берилла
На рис. 26 приведена технологическая схема переработки берилла разложением его серной кислотой. Извлечение бериллия в гидроокись по этой схеме достигает 97%.
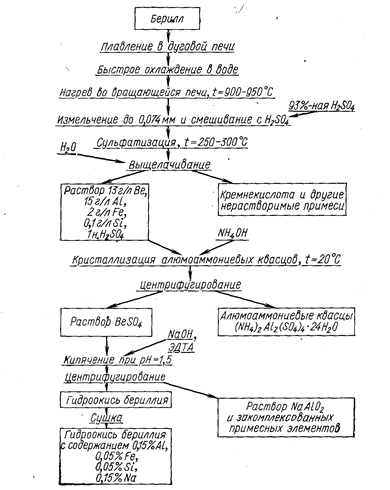
Рис. 26. Технологическая схема переработки берилла разложением его серной кислотой.
Разделение бериллия и алюминия осуществляют в две стадии, При нейтрализации раствора сульфатов бериллия и алюминия аммиаком при 20° С примерно 75% алюминия переходит в алюмоаммониевые квасцы.
Оставшийся алюминий отделяют от бериллия кипячением щелочного раствора алюмината и бериллата натрия. Бериллат натрия разлагается по реакции
Na2BeO2 + 2Н2О ® Be(ОН)2 + 2NaOH.
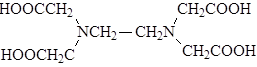 |
При этом примеси не осаждаются, так как они находятся в связанном состоянии с добавляемой этилендиаминтетрауксусной кислотой (ЭДТА):
ЭДТА является чрезвычайно сильным комплексообразователем, она переводит в раствор даже осадки сульфатов кальция и магния. Последовательные значения рК для ЭДТА при 20° С и ионной силе 0,1 равны: pК1 = 2,0; pК2 = 2,67; pК3 = 6,16; pК4 = 10,26. Первый и второй протоны отщепляются с противоположных концов молекулы. Двухвалентный анион имеет структуру с водородной связью, в которой оставшиеся два кислотных протона координируют карбоксильную группу и ион карбоксила с каждой стороны молекулы. Такая структура является причиной малой диссоциации третьего водородного иона. Последний кислотный протон иона НAn3- переходит к соседнему атому азота. Большое значение pK4 связано с отщеплением протона от атома азота.
ЭДТА образует комплексы с металлом по следующим схемам:
Men+ + H2An2- « MeAn(n-4)+ + 2Н+, при рН = 4-5;
Men+ + Han3- « MeAn(n-4)+ + Н+, при рН = 7-9;
Комплексообразование с ЭДТА можно охарактеризовать константами равновесия реакций
Men+ + An4- « MeAn(n-4)+ К=[ MeAn(n-4)+]/[ Men+].[ An4-].
Эти константы являются константами комплексообразования (табл. 19). Комплексообразование с ЭДТА широко используют в технологии и аналитической химии редких металлов.
Таблица 19
Дата добавления: 2019-05-21; просмотров: 675;











