Состояние реальных газов
При повышенных давлениях поведение нефтяного газа отклоняется от законов идеальных систем. Поведение реальных газов характеризуется межмолекулярным взаимодействием, молекулы газов начинают притягиваться друг к другу за счёт физического взаимодействия.
Для учёта этого взаимодействия уравнение (2.17) на протяжении многих лет модифицировалось голландским физиком Ван-дер-Ваальсом и другими.
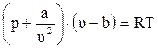 ,(2.26)
,(2.26)
где a, b – коэффициенты;
u – молекулярный объём.
Коэффициенты a, b учитывают силы взаимодействия молекул и объём, занимаемый молекулами.
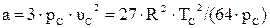 ;
; 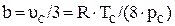 . (2.27)
. (2.27)
На основе уравнения (2.26) были качественно предсказаны многие закономерности термодинамического поведения реального газа – фазовые переходы, критические явления, эффект Джоуля–Томсона и другие. В количественном отношении уравнение Ван-дер-Ваальса обладало существенными недостатками. Широкое применение в последнее время нашли его модификации и, в частности для углеводородных систем уравнение Пенга–Робинсона (1975 г.)
Однако в инженерной практике для реальных газов используется уравнениеМенделеева–Клапейрона, содержащее коэффициент сверхсжимаемости z, предложенный Д. Брауном и Д. Катцом и, учитывающий отклонения поведения реального газа от идеального состояния:
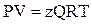 , (2.28)
, (2.28)
где Q – количество вещества, моль;
z – коэффициент сверхсжимаемости газа.
Физический смысл коэффициента сверхсжимаемости заключается в расширении граничных условий для высоких давлений уравнения Менделеева–Клапейрона.
Коэффициент z зависит от давления и температуры,приведенных критических давлений и температур, природы газа:
z = f (Тприв, Рприв), (2.29)
где Тприв – приведенная температура;
Рприв – приведенное давление.
Приведёнными параметрами индивидуальных компонентовназываются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа: температура, давление, объём, плотность и другие больше или меньше критических.
Тприв = Тпл/Тср. кр; Рприв = Рпл/Рср. кр; Vприв = Vпл/Vср. кр. (2.30)
А для смесей газов они характеризуют отношения действующих (реальных) параметров (температура, давление и др.) к среднекритическим параметрам смеси:
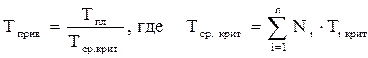 , (2.31)
, (2.31)
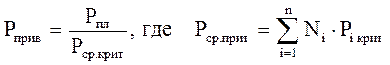 (2.32)
(2.32)
Критическая температура (Ткр) – максимальная температура, при которой газ и жидкость могут ещё сосуществовать в равновесии (табл. 2.4).
Критическое давление – давление паров вещества при критической температуре (табл. 2.4), а объём вещества, отнесённый к 1 молю или к единице массы вещества, называется критическим удельным объёмом.
Таблица 2.4
Дата добавления: 2019-02-08; просмотров: 729;











