Основные признаки объектов коллоидной химии
Рассмотрим подробнее два основных признака объектов коллоидной химии: гетерогенность и дисперсность. Все свойства объектов коллоидной химии зависят от этих признаков. Эти признаки неотделимы друг от друга. Каждый из них является необходимым, но недостаточным для отнесения системы к коллоидной. Так, истинные растворы дисперсны, но гомогенны, у них нет поверхности раздела, поэтому они не изучаются в коллоидной химии. Гетерогенность или многофазность является признаком, обеспечивающим наличие межфазной поверхности, поверхностного слоя. Это важнейший признак коллоидного состояния вещества, с ним связаны самые существенные свойства коллоидов. Гетерогенность указывает на качественную сторону объектов коллоидной химии - наличие межфазной поверхности и качество этой поверхности. Поверхность раздела представляет собой пример единства противоположностей. Молекулы на поверхности принадлежат к обеим фазам. Существование межфазной поверхности предполагает наличие поверхностного натяжения s. Величина поверхностного натяжения определяет степень различия между соприкасающимися фазами. Чем сильнее выражена гетерогенность, т.е. чем более резко отличаются фазы по своей природе, тем больше величина поверхностного натяжения. При отсутствии гетерогенности поверхностное натяжение равно 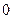 .
.
Характеризуя гетерогенность как признак коллоидных систем, связанный с поверхностью, необходимо отметить отличия молекул на поверхности от молекул в объеме. Молекулы, находящиеся на поверхности, сильно отличаются от молекул, находящихся в объеме. Первое отличие состоит в том, что молекулы на поверхности находятся в ином энергетическом состоянии по сравнению с молекулами в объеме, т. е. обладают избыточной свободной энергией. Молекулы в этом слое находятся в несимметричном силовом поле. Молекулярные силы в поверхностном слое некомпенсированы, и поэтому молекулы на поверхности обладают избытком свободной энергии 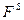 . Мерой этого избытка является поверхностное натяжение
. Мерой этого избытка является поверхностное натяжение 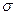 , т.е. свободная поверхностная энергия, приходящаяся на
, т.е. свободная поверхностная энергия, приходящаяся на 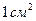 величины поверхности
величины поверхности 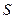 .
. 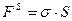 . Избыток свободной энергии на поверхности делает систему термодинамически неравновесной. Поэтому все поверхностные процессы протекают самопроизвольно в сторону уменьшения
. Избыток свободной энергии на поверхности делает систему термодинамически неравновесной. Поэтому все поверхностные процессы протекают самопроизвольно в сторону уменьшения 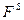 , что достигается уменьшением
, что достигается уменьшением 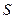 или
или 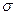 .
.
Второе отличие состоит в том, что молекулы, находящиеся в объеме и на поверхности, по-разному ориентируются. Средняя конформация молекулы в объеме и на поверхности различна. Итак, пленка стеариновой кислоты, отлитая на стекле, со стороны воздуха гидрофобна, а со стороны стекла гидрофильна.
Третье отличие заключается в том, что в случае многокомпонентных систем состав поверхностного слоя и объема различен вследствие адсорбции.
Дисперсность или раздробленность является количественным признаком объектов коллоидной химии. Применяются следующие количественные параметры раздробленности: размер частиц 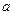 , дисперсность Д, удельная поверхность
, дисперсность Д, удельная поверхность 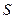 . В зависимости от формы частицы берется ее характеристический размер: для сферы - диаметр
. В зависимости от формы частицы берется ее характеристический размер: для сферы - диаметр 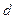 , для куба – ребро
, для куба – ребро 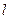 . Для частиц неправильной формы в качестве количественной характеристики раздробленности применяется удельная поверхность.
. Для частиц неправильной формы в качестве количественной характеристики раздробленности применяется удельная поверхность.
Между этими характеристиками существуют простые соотношения.
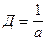 ;
; 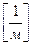 (5.1)
(5.1)
Удельная поверхность 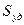 - это отношение поверхности к объему или массе. При расчете удельной поверхности на единицу объема дисперсной фазы:
- это отношение поверхности к объему или массе. При расчете удельной поверхности на единицу объема дисперсной фазы:
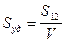 ;
; 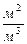 ,
, 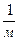 (5.2)
(5.2)
Иногда удельную поверхность относят к единице массы:
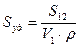 ;
; 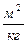 (5.3)
(5.3)
Для монодисперсной системы, содержащей n частиц сферической формы радиуса 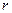 :
:
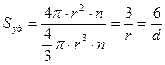 (5.4)
(5.4)
В общем случае  , где
, где 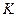 - коэффициент формы частицы. Для полидисперсной системы
- коэффициент формы частицы. Для полидисперсной системы
 , (5.5)
, (5.5)
где 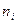 - число частиц радиуса
- число частиц радиуса 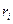 .
.
Диспергирование можно производить уменьшением одного, двух или трех измерений (рис. 1.4).
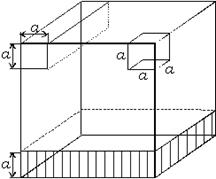
Рис. 1.4. Форма дисперсий, образующихся при изменении размеров куба в одном, двух или трех измерениях.
В зависимости от этого образуются различные дисперсии: пленки, нити или частицы. Раздробленность определяется наименьшим размером а.
Поверхностные явления возникают на любых поверхностях, независимо от их протяженности. Увеличение дисперсности приводит к увеличению роли поверхностных явлений в системе.
Дисперсность или удельная поверхность является термодинамическим параметром состояния, изменение которого вызывает изменение других равновесных свойств. В качестве примера рассмотрим гетерогенную смесь воды с бензолом, содержащую небольшое количество поверхностно-активного вещества. В высоком узком цилиндре, где межфазная поверхность вода - бензол невелика, смесь характеризуется определенным равновесным распределением ПАВ между поверхностью и объемом. Если эту смесь перелить в противень, то межфазная поверхность увеличится, количество ПАВ на поверхности увеличится, а концентрация в объеме уменьшится. Равновесие в системе изменится только за счет изменения дисперсности, или удельной поверхности при постоянстве других параметров (объема, массы, температуры, давления, числа компонентов). Это изменение является обратимым.
Если пренебречь влиянием поверхности, то, согласно правилу фаз Гиббса 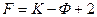 , число степеней свободы
, число степеней свободы 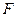 при постоянных температуре и давлению равно 1, т. е. можно изменять только количество ПАВ в системе. При постоянном содержании ПАВ
при постоянных температуре и давлению равно 1, т. е. можно изменять только количество ПАВ в системе. При постоянном содержании ПАВ 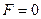 . С учетом влияния поверхности, т. е. дисперсности, появляется дополнительная степень свободы. Из приведенного примера следует, что изменение поверхности приводит к изменению распределения ПАВ, т. е. система обладает дополнительной степенью свободы
. С учетом влияния поверхности, т. е. дисперсности, появляется дополнительная степень свободы. Из приведенного примера следует, что изменение поверхности приводит к изменению распределения ПАВ, т. е. система обладает дополнительной степенью свободы 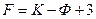 .
.
Дисперсность характеризует количество поверхности, она является количественной характеристикой, указывающей на степень раздробленности, величину межфазной поверхности.
Таблица 1.1. Дисперсность коллоидных систем
| Система | а, м | 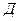 , , 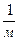
|
| Коллоидная (ультрамикрогетерогенная), частицы видимы в электронный микроскоп | 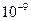 - - 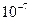
| 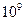 - - 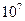
|
| Микрогетерогенная, частицы видны в обычный микроскоп | 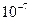 - - 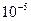
| 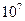 - - 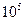
|
| Грубодисперсная, частицы видны невооруженным глазом | 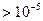
| 
|
Системы, изучаемые в коллоидной химии, характеризуются широким диапазоном дисперсности, значения которой приведены в табл.1.1.
Зависимость удельной поверхности от размера частиц приведена на рис. 1.5.
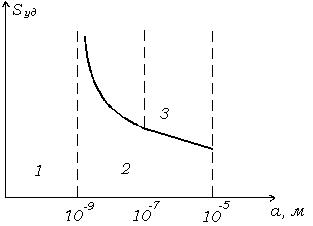
Рис. 1.5. Зависимость удельной поверхности от размера частиц.
Аналитически эта зависимость выражается формулой гиперболы. На этом графике существуют три области: 1 - истинные растворы молекулярной степени дисперсности, 2 - высокодисперсные системы с размером частиц 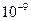 -
- 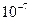 м, за которыми укрепилось название «золи», 3 - микрогетерогенные и грубодисперсные системы с размером частиц
м, за которыми укрепилось название «золи», 3 - микрогетерогенные и грубодисперсные системы с размером частиц 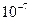 -
- 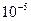 м. Эти системы представляют собой взвеси, которые со временем оседают и образуют структуры в осадке. Размер частиц в них настолько велик, что частицы видны в обычный микроскоп или даже невооруженным глазом. Поскольку крупные частицы отражают свет, эти системы обладают сильной мутностью.
м. Эти системы представляют собой взвеси, которые со временем оседают и образуют структуры в осадке. Размер частиц в них настолько велик, что частицы видны в обычный микроскоп или даже невооруженным глазом. Поскольку крупные частицы отражают свет, эти системы обладают сильной мутностью.
Дата добавления: 2020-11-18; просмотров: 599;











