Металлы и сплавы. Кристаллическое строение металлов.
Большая часть (3/4) всех химических элементов периодической системы Д. И. Менделеева – металлы. По своим свойствам они отличаются от неметаллов: сочетают высокую прочность и твердость с хорошей пластичностью, обладают литейными свойствами и возможностью механической обработки, хорошо проводят тепло и электричество, но плохо пропускают рентгеновские лучи и отражают световые волны. Эти свойства обуславливаются особенностями внутриатомного строения металлов..
У металлов электроны на внешних оболочках имеют слабую связь с ядром, легко отрываются и могут свободно перемещаться между положительно заряженными ядрами. Следовательно, в металле положительно заряженные ионы окружены коллективизированными электронами. Так как эти электроны подвижны аналогично частицам газа, то используется термин «электронный газ».
Металлургический тип связи характерен тем, что нет непосредственного соединения атомов друг с другом, нет между ними прямой связи. Атомы в металлах размещаются закономерно, образуя кристаллическую решетку.
Кристаллическая решетка - это мысленно проведенные в пространстве прямые линии, соединяющие ближайшие атомы и проходящие через их центры, 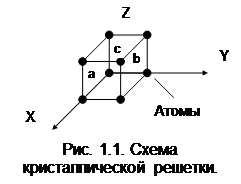
 |
относительно которых они совершают колебательные движения. В итоге образуются фигуры правильной геометрической формы - кристаллическая решетка (рис. 1.1).

Расстояния (а,b,с) между атомами , т.е. параметры кристаллической решетки, находятся в пределах 2… 6 A° (1 A°=10-8 см). Каждый атом принадлежит 8 кристаллическим решеткам. В аморфных телах с хаотическим расположением атомов в пространстве, свойства в различных направлениях одинаковы, а в кристаллических телах расстояния между атомами в различных направлениях неодинаковы, поэтому различны и свойства. Тип кристаллической решетки (рис. 1.2) зависит от металла, температуры и давления. Это используется при термообработке металлов для упрочнения их.
Реальные металлы состоят из большого количества кристаллов, различно ориентированных в пространстве относительно друг друга. На границах зерен атомы кристаллов не имеют правильного расположения, здесь скапливаются примеси, дефекты и включения. Экспериментально установлено , что внутреннее кристаллическое строение зерен не является правильным. В решетках имеются различные дефекты ( несовершенства ), которые нарушают связь между атомами и оказывают влияние на свойства металлов .
Имеются следующие несовершенства в кристаллических решетках :
1. Точечные (рис. 1.3):
а) Наличие вакансий, т. е. мест в решетке, не занятых атомами. Это происходит из-за смещения атомов от равновесного состояния. Число вакансий увеличивается с ростом температуры.
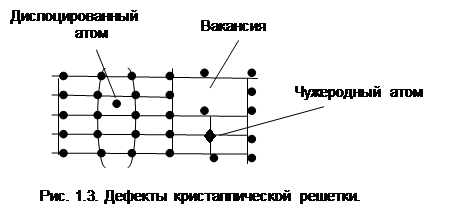 |
б) Дислоцированные атомы, т. е. атомы вышедшие из узла решетки и занявшие место в междоузлии.
в) Примесные атомы, т.е. в основном металле имеются чужеродные примеси. Например, в чугуне основными атомами являются атомы железа, а примесными- атомы углерода, которые или занимают место основного атома, или внедряются внутрь ячейки.
2. Поверхностные несовершенства, имеющие небольшую толщину при значительных размерах в двух других направлениях.
3. Линейные несовершенства ( цепочки вакансий, дислокаций и т. д.). Линейные дефекты малы в двух направлениях и значительно большего размера в третьем.
Количество дефектов в металле оказывает существенное влияние на его прочность. На первом участке кривой (рис. 1.4) при минимуме дислокаций меньше возможностей для сдвига атомов по кристаллической решетке ,поэтому будет максимум прочности металла (теоретическая, недостижимая прочность). Путем восстановления из хлористого или бромистого железа в лабораторных условиях выращивают «усы» кристаллов железа длиной до 10 см и диаметром 0,5 … 1 мкм , имеющие относительно высокую прочность на растяжение (бb = 1200 …1300 кгс / мм2). Для сравнения, высокопрочная сталь имеет прочность всего 150 …200 кгс / мм2 , т.е. на порядок ниже, а прочность железных «усов» примерно в 100 раз выше , чем у обычного железа (минимум на кривой) .

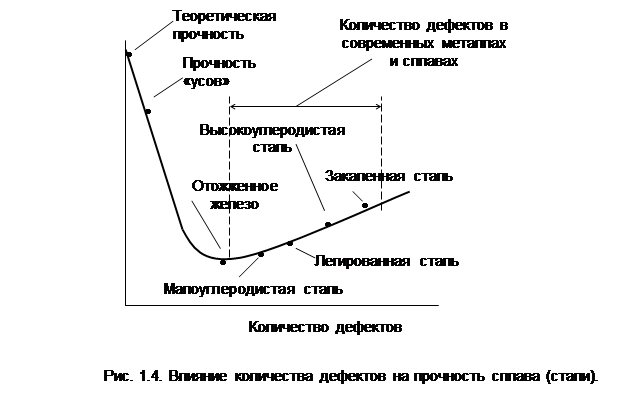
Повышение прочности с увеличением плотности дислокаций выше их критического значения объясняется тем , что имеются не только параллельные , но и взаимопересекающиеся ( объемные ) дислокации . Они препятствуют взаимному перемещению металла и, как результат, приводят к увеличению прочности металла.
Все современные способы упрочнения металлов (легирование, закалка, прокатка, ковка, штамповка, волочение и т.д.) – это увеличение количества дефектов в металле. Наивысшая прочность, которую можно получить путем увеличения количества дефектов в металле , составляет около 1/3 от теоретически возможной (идеальной) прочности.
Кристаллизация металлов.
 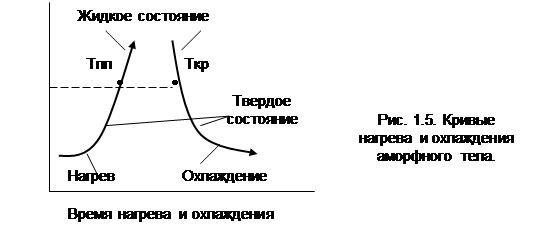 |
При нагреве и охлаждении (рис. 1.5) аморфных тел ( смола, стекло, пластмассы,…) при переходе из жидкого в твердое состояние качественных изменений не происходит. В твердом состоянии атомы в аморфном теле расположены так же хаотично, как и в жидком, имеют только меньшую степень перемещения. Из рис 1. 5 видим, что температура плавления Тпл равняется температуре кристаллизации Ткр, а переход из одного состояния в другое ( из твердого в жидкое- точка Тпл ,и из жидкого в твердое- точка Ткр ) происходит скачкообразно.
По другому ведут себя металлы ( рис. 1.6). На участке 1 - 2 происходит нагрев металла ; кристаллическая решетка сохраняется, но атомы увеличивают амплитуду колебаний за счет поглощенной тепловой энергии. На горизонтальном участке 2 - 3 также подводится тепло, но температура Тпл не повышается, т.к. подводимое тепло целиком расходуется на разрушение кристаллической решетки. Атомы переходят в неупорядоченное (жидкое) состояние . После разрушения последнего участка кристаллов, после точки 3 начинается повышение температуры жидкого металла по линии 3 - 4.
 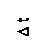  |
При охлаждении (4- 5) на горизонтальном участке 5 - 6 происходит кристаллизация, при которой выделяется тепло, поэтому процесс проходит при постоянной температуре Ткр. Кристаллизация металла происходит не при температуре плавления Тпл , а при некотором переохлаждении Dt, величина которая зависит от природы металла, наличия примесей и от скорости охлаждения.
Кристаллизация начинается с того , что при понижении температуры до значения Ткр начинают образовываться мелкие кристаллики, называемые центрами кристаллизации ( зародышами ). При дальнейшем уменьшении энергии металла происходит рост кристаллов и в то же время в жидкости возникают новые центры кристаллизации, т.е. процесс кристаллизации состоит из двух одновременно происходящих процессов :зарождение новых центров кристаллов и роста кристаллов из ранее образованных центров.
 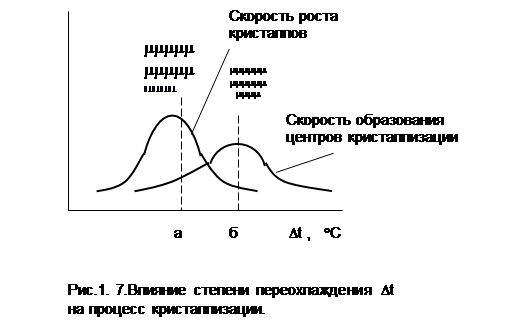 |
Скорости кристаллизации и числа центров в зависимости от Dt изменяются по закону нормального распределения (рис.1.7).
 |
При переохлаждении (б) образуется мелкое зерно, т. к кристаллы быстро образуются, но медленно растут ,а при меньших (а) значениях Dt возникает крупное зерно. Мелкокристаллический металлболее твердый и прочный, чем крупнокристаллический. Следовательно, подбором температуры переохлаждения Dt можно регулировать механические характеристики металла. Многое зависит от количества нерастворимых примесей, которые являются центрами кристаллизации. Чем больше этих частиц, тем меньше зерна металла.
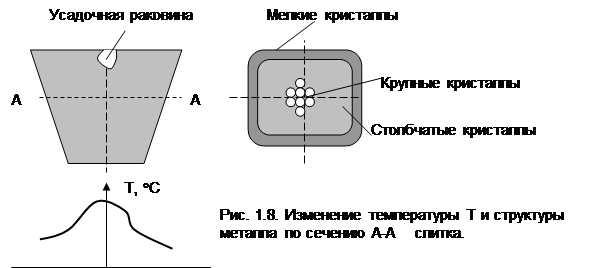
Влияние степени переохлаждения Dt на процесс кристаллизации хорошо видно в структуре слитка (рис. 1.8). Полученная в конверторе или в мартене, сталь (0,5…3 тн) заливается в изложницу . Большой перепад температур (свыше 1500 °С) будет между расплавленным металлом и атмосферой по высоте и ширине слитка. В результате на поверхности слитка, т. е. там, где имеется наибольший перепад температур, будет мелкозернистая структура, а в центре слитка при минимальном перепаде температур возникнут при кристаллизации крупные , а между ними –столбчатые кристаллы .
Российские ученые и практики сделали много открытий в металловедении и технологии обработки металлов. Так, основы научной металлургии и геологии заложил еще Михаил Васильевич Ломоносов ,об этом свидетельствует написанный им в 1763 году труд «Первые основания металлургии или рудных дел».
Дмитрий Иванович Менделеев систематизировал в периодической таблице химические элементы, что способствовало развитию многих вопросов металловедения ( из известных в то время 63 химических элемента 50 были металлами). Родоначальником металлургии является и русский горный инженер Павел Петрович Аносов (1797…1851 г.), работающий в городе Златоусте на Урале. Он впервые применил световой микроскоп для изучения микроструктур металлов и нашел секрет булатной стали, заложил основы легирования стали (исследовал добавки золота, платины, хрома, марганца и других элементов к стали).
Дмитрий Константинович Чернов (1839…1921 г.) - основоположник теории и строения стального слитка. Работал на Обуховском заводе г. Санкт-Петербурга.
Дата добавления: 2020-11-18; просмотров: 448;











