Характеристичне рентгенівське випромінювання, його природа. Закон Мозлі
Характеристичний спектр виникає тому, що частина бомбардуючих електронів проникає в атоми антикатода і збуджує їх. Причому електронні переходи відбуваються в надрах атомів, тобто в оболонках, ближчих до ядра - 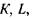
 Тому енергія квантів рентгенівських променів більша від енергії квантів видимого світла, так як останні отримуються при електронних переходах між зовнішніми оболонками атома, тобто на його периферії.
Тому енергія квантів рентгенівських променів більша від енергії квантів видимого світла, так як останні отримуються при електронних переходах між зовнішніми оболонками атома, тобто на його периферії.
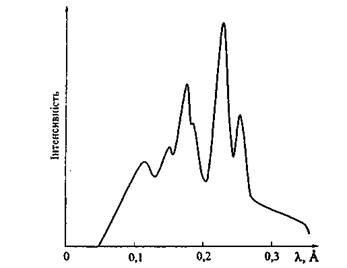
Рис. 8.3. Розподіл інтенсивності по спектру випромінювання рентгенівської трубки з вольфрамовим анодом.
Характеристичне випромінювання має лінійчатий спектр. Свою назву воно дістало тому, що цей тип рентгенівського випромінювання характеризує речовину антикатода і його вид не залежить від того, чи елемент знаходиться у вільному або хімічно зв'язаному стані. Характеристичні лінії завжди виникають на фоні неперервного спектра.
На рис. 8.3 зображено графік розподілу інтенсивності по спектру випромінювання рентгенівської трубки з вольфрамовим анодом при 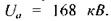 Цей графік наочно ілюструє той факт, що загальний спектр включає в себе як неперервний спектр, так і характеристичні лінії K-серії. На ділянці неперервного спектра, розміщеного зліва від накладених на нього спектральних ліній, видний "провал". Ця відсутня енергія пішла на збудження сусідніх спектральних ліній.
Цей графік наочно ілюструє той факт, що загальний спектр включає в себе як неперервний спектр, так і характеристичні лінії K-серії. На ділянці неперервного спектра, розміщеного зліва від накладених на нього спектральних ліній, видний "провал". Ця відсутня енергія пішла на збудження сусідніх спектральних ліній.
На рис. 8.4 схематично зображено виникнення різних серій характеристичних рентгенівських променів. В атомах з більшим атомним номером внутрішні електронні оболонки К, L, М повністю заповнені електронами. При вилученні електрона з однієї із внутрішніх оболонок на звільнене місце переходить електрон з більш віддаленої від ядра оболонки і ви промінюється рентгенівський квант.
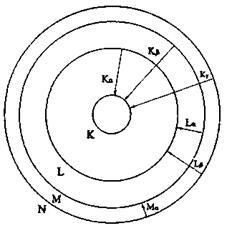
Рис.8.4. Виникнення різних серій характеристичних рентгенівських поменів
Переходи, що закінчуються на К-оболонці, дають К-серію характеристичного спектра, яка складається - з трьох ліній:
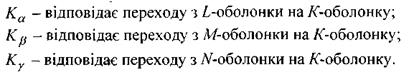
Переходи, що закінчуються на І-оболонці та М-оболонці, дають відповідно І-серію і М-серію характеристичного рентгенівського спектра. Характеристичний спектр складається із 8-10 ліній, що утворюють К, L, М-серії. Для важких елементів в кожну серію входять три лінії 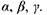 Найінтен-
Найінтен-
сивніша в характеристичному спектрі 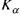 -лінія, так як ймовірність переходів на К-оболонку з L-оболонки більша, ніж з М, NTd інших більш віддалених оболонок.
-лінія, так як ймовірність переходів на К-оболонку з L-оболонки більша, ніж з М, NTd інших більш віддалених оболонок.
Для кожного атома існує межа збудження к-серії.
Наприклад, для ртуті 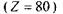 вона становить близько
вона становить близько 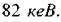 Це пов'я-
Це пов'я-
зано з тим, що для виривання електрона із найближчої до ядра К-оболонки, на якій електрони найсильніше притягуються до ядра, необхідна значна енергія, яка іде на виконання роботи по вириванню електрона. Тому лінії характеристичного спектра з'являються тільки при напрузі на рентгенівській трубці, яка більша певного значення для кожного матеріалу анода.
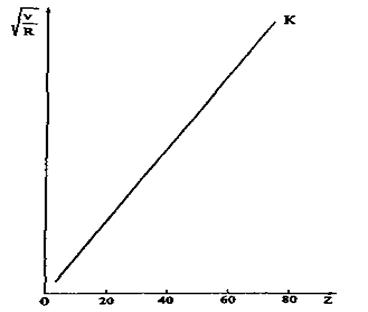
Рис. 8.5. Діаграма Мозлі.
Закон Мозлі. В 1913 р. англійський фізик Мозлі, досліджуючи залежність довжини хвилі характеристичних променів від атомного номера Z різних елементів, встановив співвідношення, які називаються законом Мозлі:
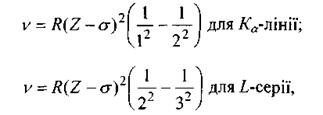 (8.4)
(8.4)
де 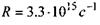 - стала Ридберга; а - постійна величина, яка називається сталою екранування (для лінії
- стала Ридберга; а - постійна величина, яка називається сталою екранування (для лінії 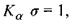 для
для 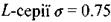 ). На рис. 8.5 зображено так звану діаграму Мозлі, яка ілюструє для ліній
). На рис. 8.5 зображено так звану діаграму Мозлі, яка ілюструє для ліній 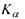 лінійну залежність
лінійну залежність 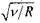 від атомного номера Z. Послідовне застосування формули Мозлі до елементів періодичної системи Менделєєва підтвердило в свій час закономірне зростання на одиницю заряду ядра при переході від одного елемента до іншого. Це стало природничо-науковим підтвердженням справедливості ядерної моделі атома і періодичного закону Д. І. Менделєєва.
від атомного номера Z. Послідовне застосування формули Мозлі до елементів періодичної системи Менделєєва підтвердило в свій час закономірне зростання на одиницю заряду ядра при переході від одного елемента до іншого. Це стало природничо-науковим підтвердженням справедливості ядерної моделі атома і періодичного закону Д. І. Менделєєва.
Дата добавления: 2020-11-18; просмотров: 598;











