Реагенты – модификаторы
Реагенты модификаторы или регуляторыприменяются для изменения гидратируемости поверхности минералов путем регулирования действия собирателей на их поверхность. По влиянию на процесс флотации минералов реагенты – регуляторы подразделяются на депрессоры ( подавители), активаторы и реагенты - регуляторы среды. Иногда к реагентами-регуляторам относятся флокулянты и пептизаторы.
Если реагенты – депрессоры предотвращают адсорбцию собирателей и повышают гидрофильность поверхности минералов, то реагенты- активаторы способствуют взаимодействию реагентов - собирателй с поверхностью минералов.
Депрессоры и активаторы позволяют из полиметаллических руд, содержащих несколько ценных минералов цветных металлов, выделить их в самостоятельные концентраты. Так при флотации свинцово-цинково-пиритных руд, содержащих галенит PbS, сфалерит ZnS и пирит FeS2 , вначале флотируется галенит, а флотируемость сфалерита и пирита подавляется реагентами депрессорами – цинковым купоросом с сернистым натрием и известью. После свинцовой флотации после активации сфалерита медным купоросом флотируется сфалерит в цинковый концентрат, а пирит выделяется в виде камерного продукта при его депрессии известью. Флотационная способность пирита может быть восстановлена при нейтрализации щелочности, например, серной кислотой.
Реагенты – депрессоры, применяемые в настоящее время в практике флотации, представлены как неорганическими, так и органическими соединениями. Механизм депрессирующего действия этих соединений на минеральную поверхность может быть различным.
Во – первых, депрессор может образовывать на поверхности минерала труднорастворимое гидрофильное соединение, которое предотвращает адсорбцию собирателя или вытесняет ионы собирателя.
Во – вторых, депрессоры могут связывать ионы активатора как в объеме пульпы, так и на поверхности минерала, предотвращая ее активацию.
В – третьих, депрессор может образовывать труднорастворимое гидрофильное соединение с собирателем в пульпе, которое уже не будет обладать собирательными свойствами.
В – четвертых, на поверхности минералов могут закрепляться гидрофильные нерастворимые неорганических или органических соединений, предохраняющие поверхность от адсорбции собирателей.
Иногда депрессия достигается сочетанием нескольких способов.
При взаимодействии реагентов – депрессоров с минералами необходимо учитывать продолжительность их контакта, температуру пульпы, концентрацию реагентов, влияющих на скорость реакций в пульпе и на поверхности минералов. Время контакта с депрессорами обычно составляет 10…20 и более минут.
К числу депрессоров, широко применяющихся при флотации руд цветных и редких металлов, относятся такие неорганические соединения как щелочи, сернистый натрий, цинковый купорос, соли синильной кислоты, соединения оксидов серы, хроматы и бихроматы, жидкое стекло, фосфаты, плавиковая кислота и ее соли, а также органические соединения такие как карбоксиметилцеллюлоза, крахмал, декстрин, танин и др.
Для депрессии минералов, содержащих железо ( пирит, пирротин, арсенопирит,ентландит и др) широко применяются щелочи и их соли. К ним относятся прежде всего известь, кальцинированная сода или карбонат натрия Na2CO3 и каустическая сода или гидроксид натрия NaOH, которые используются также как регуляторы среды.
В качестве депрессоров щелочи и их соли применяются для депрессии пирита при отделении его от сульфидов мели и сфалерита, а также при отделении пирротина и пентландита от сульфидов меди. Депрессия пирита в присутствии щелочи осуществляется при десорбции слоя адсорбированного ксантогената и при образовании на его поверхности гидроксида Fe(OH)2.
Наиболее широкое распространение получила негашеная известь, которая применяется виде известкового «молока» и которая может создать концентрацию гидроксильных ионов, соответствующую значению рН до 12,5, в то время как предельное значение рН, создаваемое содой не превышает 10,5.
Едкий натр, сода и известь частично или полностью десорбируют с поверхности многих несульфидных минералов олеиновую кислоту, поэтому применяются при селективной флотации, например. литиевых и бериллиевых руд.
Сернистый натрий Na2S получают в промышленности восстановлением сульфата натрия углем при температуре 1200˚С. Полученный плав выщелачивают и щелок, содержащий 28…32% Na2S отделяют от шлама и выпаривают при температуре 140…180˚С с получением плавленого сернистого натрия, который содержит 63…68% Na2S.
Сернистый натрий широко применяется при флотации сульфидных и несульфидных минералов как депрессор, например, сульфидных минералов, и как активатор, например окисленных минералов цветных металлов, а также как десорбент собирателей и регулятор рН пульпы.
Сернистый натрий представляет собой соль сильного основания и слабой кислоты и в водных растворах распадается на ионы
Na2S → 2Na+ + S2-
Ион S2- как анион слабой сероводородной кислоты H2S в воде подвергается гидролизу, который протекает в две стадии
S2- + H2O → HS¯ + OH¯
HS¯ + H2O → H2S + OH¯
Поэтому в зависимости от рН в пульпе могут присутствовать H2S, HS¯ и S2- (рис.159).
 При гидролизе сернистого натрия создается сильная щелочная среда.
При гидролизе сернистого натрия создается сильная щелочная среда.
Депрессирующее действие сернистого натрия связано прежде всего с десорбцией собирателя с минеральной поверхности с заменой ионов ксантогената на сульфид- или гидросульфид-ион, благодаря образованию с катионами тяжелых металлов более труднорастворимых сульфидных соединений типа MeS, чем ксантогенаты этих металлов. Кроме того, депрессия сульфидных минералов сернистым натрием может происходить при гидрофилизации Рис.159.Диаграмма состояния сернистого натрия в поверхности минералов в результате сорбции
растворе в зависимости от рН ионовS2- и ОН образующиеся при гидролизе.
Способность ионов S2- и HS¯вытеснять с поверхности сульфидов анионы ксантогената используются при селективной флотации сульфидных коллективных концентратов с применением сернистого натрия как десорбента собирателя. Повышенные концентрации сернистого натрия применяются для депрессии сульфидов меди и железа при флотации молибденита, который не депрессируется сернистым натрием.
Сернистый натрий является хорошим сульфидизатором ( активатором) окисленных минералов тяжелых металлов- карбонатов и сульфатов свинца и меди. При сульфидизации, например, церуссита PbCO3, при рН не более 9,5 образуется пленка сульфида свинца
PbCO3 + Na2S = PbS + Na2CO3,
вследствие чего минерал хорошо флотируется ксантогенатами. В более щелочной среде пленка образующегося сульфида свинца отслаивается с образованием коллоидного сернистого свинца. При рН более 11 поверхность минералов покрывается слоем гидроксида, препятствующим сульфидизации минералов и закреплению ксантогената.
Цианиды – соли синильной кислоты являются депрессорами пирита, сфалерита, сульфидных медных минералов, минералов серебра, ртути, кадмия и никеля. Для флотации обычно используются щелочные цианиды NaCN и KCN, являющиеся солями сильного основания и слабой синильной кислоты HCN.
Цианиды хорошо растворимы в воде, в водном растворе гидролизуются с выделением цианистого водорода, являющегося сильнейшим ядом
NaCN + H2O → NaOH + HCN,
Поэтому применяются цианиды исключительно в щелочных средах, в которых они не подвергаются гидролизу.
Использование цианидов имеет целый ряд недостатков: сильная токсичность, что требует особой осторожности при работе с ними, высокая стоимость, растворение золота, присутствующего в рудах.
Основная область использования цианидов при переработке минерального сырья – извлечение золота и серебра методом цианирования, где используется способность этих металлов образовывать с цианидами комплексные хорошо растворимые соединения, например,
4NaCN + 2Au + 0,5O2 + H2) → 2Na[Au(CN)2] + 2NaOH
В последнее время ввиду большой токсичности цианистых соединений применение их в качестве депрессоров значительно ограничено.
В основе депрессирующего действия цианидов лежит их способность образовывать труднорастворимые комплексы с металлами. Механизм депрессирующего действия их при флотации сульфидов тяжелых металлов состоит в разрушении в разрушении образующего на поверхности минералов химического соединения – ксантогената металла или в образовании на поверхности минерала комплексного цианистого иона, предотвращающего адсорбцию ксантогената.
В зависимости от подавляющего действия цианидов минералы тяжелых металлов подразделяются на три группы ( Каковский И.А.).
В первую группу входят минералы, металлы которых Pb, Bi, Sn, As и Ru не образуют с цианидами труднорастворимых цианистых комплексов, а ксантогенаты этих металлов не взаимодействуют с цианидами, т.е не растворяются в цианистых растворах.
Во вторую группу входят минералы, содержащие Hg, Cd и Сu, которые при избытке циан-ионов образуют с комплексные соединения Hg(CN) 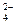 , Cd(CN)
, Cd(CN) 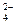 , Cu(CN)
, Cu(CN) 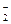 . Цианиды на эти минералы оказывают депрессирующее действие, но при повышенном расходе, а ксантогенаты этих металлов слабо растворяются в цианистых растворах.
. Цианиды на эти минералы оказывают депрессирующее действие, но при повышенном расходе, а ксантогенаты этих металлов слабо растворяются в цианистых растворах.
В третью группу входят минералы, содержащие Zn, Pt, Ni, Au, Fe, которые очень чувствительны к депрессирующему действию цианидов. Ксантогенаты этих металлов хорошо растворяются в цианистых растворах, например,
(ROCS2)2Fe + 6 CN¯ = Fe(CN) 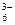 + 2ROCS
+ 2ROCS 
Используя такую классификацию можно определить возможность селективного разделения минералов цианидами. Разделение минералов, входящих в одну группу, практически невозможно. Наиболее легко и при небольших расходах цианидов разделяются минералы первой и третьей группы, например, свинцовые и цинковые минералы. Минералы первой и второй групп разделяются только при больших расходах цианида, а отделение минералов второй группы от минералов третьей возможно с применением сочетания цианида с другими депрессорами, напримет, цинковым купоросом.
Для депрессии вторичных сульфидных минералов меди, которые хорошо растворяются в цианистых растворах, используются ферри – и ферроцианиды K3[Fe(CN)6] и K4[Fe(CN)6]. Эти соединения могут применяться в слабокислой или нейтральной среде при разделении , например, медно-свинцовых концентратов, в которых медь представлена вторичными сульфидами – борнитом и халькозином.
Цинковый купорос ( сульфат цинка) ZnSO4·H2O применяется для депрессии цинковой обманки самостоятельно, а также в сочетании с цианидом или сернистым натрием.
Депрессирующее действие цинкового купороса объясняется тем, что в нейтральной и щелочной средах образуются осадки гидроксида цинка Zn(OH)2 и карбоната  цинка ZnCO3, которые при рН 7…10,5 налипают на поверхности цинковой обманки и депрессируют его.
цинка ZnCO3, которые при рН 7…10,5 налипают на поверхности цинковой обманки и депрессируют его.
В присутствии цианида в пульпе образуются труднорастворимые цианид цинка Zn(CN)2, а также комплексные соединения Zn(CN) 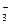 и Zn(CN)
и Zn(CN) 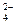 , депрессирующее действие которых объясняется замещением меди и железа кристаллической решетки минерала цинком комплексной соли, при котором перешедшие в раствор медь и железа образуют более устойчивые соединения типа KCu(CN)2. Таким образом происходит дезактивация поверхности сфалерита.
, депрессирующее действие которых объясняется замещением меди и железа кристаллической решетки минерала цинком комплексной соли, при котором перешедшие в раствор медь и железа образуют более устойчивые соединения типа KCu(CN)2. Таким образом происходит дезактивация поверхности сфалерита.
При селективной флотации сульфидных руд в качестве депрессоров могут применяться сульфоксидные соединения. К ним относятся: сернистый газ SO2, сернистая кислота H2SO3, сульфиты и тиосульфаты щелочных и щелочноземельных металлов, например, Na2SO3 и Na2S2O3. Эти соединения совместно с железным купоросом депрессируют галенит при разделении медно-свинцовых концентратов, а совместно с сернистым натрием или цинковым купоросом депрессируют цинковую обманку. Действие сульфита и тиосульфата натрия как восстановителей связано с поглощением кислорода из пульпы и предотвращением окисления сульфидной поверхности, что препятствует адсорбцию собирателя. Кроме того, сульфоксидные соединения могут образовывать с ионами железа, меди, свинца, золота и серебра довольно прочные комплексные соединения, способные растворять ксантогенаты металлов.
Хроматы и бихроматы калия и натрия K2Cr2O4 и Na2Cr2O4 (соли хромовой и двухромой кислот) являются депрессорами галенита и применяются при разделении свинцово – медных концентратов. При флотации обычно используются щелочные соли двухромовой кислоты. Депрессирующее действие бихроматов на сульфид свинца обусловлено их способностью окислять сульфидную поверхность и взаимодействовать с катионвми окисленной поверхности с образованием труднорастворимого соединения – хромата свинца PbCrO4 , а также сорбцией на минеральной поверхности различных гидрофильных комплексов Cr (III).
Жидкое стекло – растворимая в воде щелочная соль кремниевых кислот nNa2O· mSiO2 – наиболее широко применяемый депрессор минералов вмещающих пород ( силикатов, карбонатов) при флотации руд цветных и особенно редких металлов. Жидкое стекло поступает на обогатительные фабрики в виде силикат-глыбы, которая представляет собой прозрачные бесцветные или светло-зеленые и желтоватые куски. Получают жидкое стекло сплавлением кварца с содой или сульфатом натрия в присутствии угля при температуре 1300 – 1500˚С. Химический состав жидкого стекла непостоянен, характеризуется он модулем, т.е. числом молекул SiO2 , приходящихся на одну молекулу Na2O, который равен 2,0…4,5. При флотации применяют обычно 5% -ные растворы жидкого стекла с модулем 2,2…3,0. При модуле более 3,0 жидкое стекло трудно растворяется в воде, образует коллоидные растворы и крупные гели кремниевой кислоты. Жидкое стекло с модулем менее 2,2 создает сильно щелочную среду, в которой снижается его депрессирующее действие.
Жидкое стекло диссоциирует в водных растворах по реакциям
Na2SiO3 + 2H2O 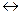 H2SiO3 + 2Na+ + 2OH¯
H2SiO3 + 2Na+ + 2OH¯
H2SiO3→ H+ +HSiO 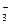
HSiO 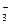 → H+ + SiO
→ H+ + SiO 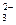
Состав продуктов диссоциации зависит от рН раствора. Так, при рН< 8 в растворе присутствуют в основном недиссоциированная кремниевая кислота H2SiO3, при рН 9 – ионы HSiO 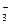 и недиссоциированная H2SiO3 , при рН 10…12 – в основном ионы HSiO
и недиссоциированная H2SiO3 , при рН 10…12 – в основном ионы HSiO 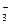 , а при рН 13 преобладают ионы SiO
, а при рН 13 преобладают ионы SiO 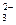 . Эти продукты диссоциации жидкого стекла, а также его коллоидная форма могут взаимодействовать с поверхностью минералов, предотвращая адсорбцию собирателя или десорбируя его.
. Эти продукты диссоциации жидкого стекла, а также его коллоидная форма могут взаимодействовать с поверхностью минералов, предотвращая адсорбцию собирателя или десорбируя его.
При флотации жирнокислотными собирателями жидкое стекло применяется для депрессии кварца и других силикатных минералов, кальцита, апатита и флюорита, а также пирохлора.
Кремнефтористый натрий Na2SiF6 применяется в качестве регулятора среды и селективного депрессора при разделении рутила и циркона, пирохлора и циркона. Депрессия минералов может быть следствием создания кислой среды, в которой затрудняется адсорбция жирных кислот, следствием образования коллоидных частиц геля кремниевой кислота, ионов SiF 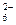 и мицелл, содержащих эти ионы и адсорбирующихся на поверхности минералов.
и мицелл, содержащих эти ионы и адсорбирующихся на поверхности минералов.
Для депрессии минералов, содержащих железо и щелочноземельные металлы применяется гексаметафосфат натрия Na6P6O18 который является также эффективным подавителем пептизатором шламистых частиц таких минералов, как кварц, кальцит, апатит. Этот реагент также способен связывать катионы поливалентных металлов в пульпе, иногда успешно заменет жидкле стекло. Депрессирующее действие гексаметафосфата связано с закреплением его на поверхности минерала с образованием гидрофильных соединений. Взаимодействуя с катионами железа и кальция, образует прочные комплексные соединения, что снижает расход собирателя и улучшают селективность процесса флотации.
В практике флотационного обогащения используются такие органические подавители, как карбоксиметилцеллюлоза ( КМЦ), крахмал, декстрин, танин, производные лигнита и пр.
Карбоксиметилцеллюлоза ( КМЦ) – водорастворимая натриевая соль карбоксиметилового эфира целлюлозыявляется депрессором вторичные силикаты – тальк, хлорит, пироксены, а также циркона и сульфидов – халькопирита, галенита и сфалерита. Применяется она например, для депрессии минералов вмещающих пород типа талька при флотации медно-никелевых руд ( рН 8…10).
Крахмал как и целлюлоза относятся к классу высокомолекулярных соединений – полисахаридов. Крахмал нерастворим в холодной воде, в горячей он сначала набухает, а затем постепенно растворяется. Применяется крахмал для депрессии оксидов железа в щелочной среде при рН более 10,5, для депрессии серицта при флотации сульфидов, депрессии барита и кальцита при отделении от флюорита, также для депрессии молибдените при его отделении от сульфидов меди из коллективного медно-молибденового концентрата.
Декстрин является продуктом неполного гидролиза крахмала, растворим в воде с образованием клейкой массы. Применяется в качестве депрессора сподумена и оксидов железа при флотации кварца, слюды и полевых шпатов катионными собирателями. Является также хорошим депрессором серицита, талька, вторичных силикатов, барита и молмбденита.
В качестве депрессоров при флотации часто применяются дубильные вещества, например, танин, которые содержаться в коре некоторых деревьев. Эти вещества обычно хорошо растворимы в воде.
К дубильным веществам относится также квебрахо, содержащиеся в дубовой коре. Применяются дубильные вещества при флотации несульфидных минералов для депрессии оксидов железа, кальцита и доломита.
В качестве органических подавителей применяются также щавелевая кислота (СООН)2, которая депрессирует железосодержащие минералы при флотации, например, касситерита, а также лимонная кислота, которая является депрессором флюорита, граната, ставролита и слюды.
Реагенты – активаторы применяются во флотационном процессе для активации поверхности минералов, в результате которой создаются условия для закрепления реагентов-собирателей и флотации минералов. Активаторы применяются тогда, когда поверхность минералов не может взаимодействовать с собирателем недостаточно или минералы были задепрессированы.
Активация происходит либо при образовании на поверхности минерала активирующего поверхностного соединения, либо при растворении депрессирующего поверхностного слоя. В первом случае активация обычно происходит в результате ионного обмена. Примером может служить активация поверхности сфалерита ионами меди, добавляемой в виде медного купороса. В этом случае на поверхности сфалерита за счет обменной реакции образуется пленка сульфида меди
ZnS + Cu2+ → CuS + Zn2+
которая взаимодействует с собирателем – ксантогенатом.
Обменная химическая реакция происходит при активации некоторых окисленных минералов тяжелых цветных металлов, при которой с их поверхности ионыSO 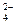 илиСО
илиСО 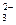 вытесняются ионами S2-.Поэтому такой процесс активации называется сульфидизацией, которая происходит при участии ионовS2- и HS-, образующихся в результате гидролиза и диссоциации сернистого натрия Na2S
вытесняются ионами S2-.Поэтому такой процесс активации называется сульфидизацией, которая происходит при участии ионовS2- и HS-, образующихся в результате гидролиза и диссоциации сернистого натрия Na2S
Na2S + H2O ↔  NaSH + NaOH
NaSH + NaOH
А затем поверхность окисленного минерала, например церуссита, взаимодействует с продуктами гидролиза
PbCO3 + 3NaOH = NaHPbO2 + Na2CO3 + H2O
NaSH + NaHPbO2 = 2NaOH + PbS
или
PbCO3 + Na2S = PbS + Na2CO3
Сульфид свинца образуется на поверхности церуссита в виде пленки, которая и взаимодействует с ксантогенатами как сульфидный минерал. По такому же механизму сульфидизируются и окисленные минералы меди – малахит, азурит, куприт.
Еще одним примером такого механизма является активация кварца, например, ионами железа при флотации его карбоксильными собирателями.
Активация может происходить и за счет химической очистки поверхности минералов от пленок, которые мешают адсорбции собирателя. Например, при окислении пирита на его поверхности образуется пленка гидрооксидов железа или труднорастворимых основных сульфатов железа, которая предотвращает адсорбцию собирателя. При обработке серной кислоты пленки гидроксидов и основных сульфатов железа растворяются и пирит восстанавливает свои флотационные свойства.
Реагенты – активаторы являются в основном неорганические кислоты и соли. Прежде всего это серная кислота, которая применяется при флотации слюды, рутила,енита, пирохлора, циркона, ильменорутила и других минералов редких металлов.
Медный купорос CuSO4· 5H2O – один из наиболее широко применяемых активатором, который активирует флотацию сфалерита, пирита и пирротина. Скорость взаимодейтсвия минералов с медным купоросом зависит от рН пульпы. В кислой и нетральной среде концентрация ионов двухвалентной меди будет выше, чем в щелочной, поэтому в щелочных пульпах время на активацию требуется больше. Время контактированя пульпы с медным купоросом составляет обычно 5…10 минут, а расход медного купороса обычно составляет 0,2…0,4 кг/т.
Соли железа являются активаторами не только ценных минералов, но и таких минералов вмещающих пород, как кварц, турмалин. Кроме того, катионы железа, так же как катионы кальция и магния ( «неизбежные ионы») связывают в объеме пульпы ионы собирателя, например, олеиновой кислоты, что вызывает повышенный расход собирателя и значительно ухудшает селективность процесса флотации. Поэтому при флотации многих руд редких металлов после киалотной обработки осуществляют отмывку «неизбежных ионов» или связывают их в труднорастворимые гидроксиды с помощью щелочи.
Как указывалось выше, в качестве активатора (сульфидизатора) окисленных минералов цветных металлов, широко применяется сернистый натрий Na2S.
Плавиковая кислота HF иногда применяется для активации полевых шпатов и берилла, уксуснокислый свинец Pb(C2H3O2)2 является активатором антимонита Sb2S3.
Реагенты – регуляторы среды применяются для создания необходимой кислотности или щелочности пульпы, в которой происходит флотация минералов.
Для получения оптимальных технологических показателей необходимо во флотации поддерживать оптимальное значением концентрации ионов водорода (рН).
Влияние значения рН на флотацию многогранно.
Во-первых, ионы водорода оказывают влияние на устойчивость гидратных слоев и могут изменять степень гидратации поверхности минерала, т.е. его флотируемость.
Во-вторых , изменяя значение рН, можно регулировать процесс диссоциации реагентов, т.е. изменять их свойства и растворимость. Регулируя величину рН, можно поддерживать необходимую концентрацию различных форм собирателей и таких регуляторов, как цианид, сернистый натрий, жидкое стекло.
В- третьих, щелочность или кислотность оказывают влияние на состояние поверхности минерала, изменяя его и регулируя степень взаимодействия с собирателем.
В – четвертых, создание определенной щелочности способствует выведению из жидкой фазы пульпы ионов тяжелых металлов в виде гидроксидов, например,
Fe3+ + 3OH¯ ↔ Fe(OH)3 ,
что снижает расход собирателя и повышает селективность процесса флотацию.
В качестве регуляторов щелочности или кислотности пульпы применяются щелочи ( известь, сода, едкий натр) и кислоты ( серная кислота, щавелевая или уксусная кислота), а также реагенты, изменяющие концентрацию водородных ионов вследствие гидролиза ( сернистый натрий, железный и медный купорос, жидкое стекло и др).
Известь СаО наиболее дешевый и распространенный реагент, применяемый для создания щелочной среды, например, при депрессии пирита. Применяется обычно негашеная известь, которая обрабатывается водой с получением гидроксида кальция СаО + Н2О = Са(ОН)2 и применяют в виде суспензии, называемой известковым «молоком». Насыщенный раствор Са(ОН)2 имеет высокую щелочность и создает значение рН более 12. Обычно при таких значениях рН щелочность пульпы определяется по содержанию свободной СаО в 1 дм3.
Кальцинированная содаNa2CO3 (безводныйуглекислый натрий или карбонат натрия), а также гидрокарбонат натрия NaHCO3 (двууглекислый натрия, питьевая сода) хорошо растворяются в воде и в результате гидролиза ее растворы приобретают щелочной характер, но величина рН не превышает 11. Поэтому соду применяют для создания рН от 7 до 10.
Каустическая сода или каустик – это техническое название едких щелочей – гидроксида натрия NaOH и гидроксида калия КОН, которые также применяются для создания щелочной среды, особенно когда необходимо исключить влияние на флотацию ионов кальция.
Серная кислотаH2SO4 широко применяется для создания среды со значением рН менее 7 при флотации рутила, ильменита, пирохлора и циркона катионными собирателями, алкилсульфатами и реагентом ИМ-50 ( алкилгидраксамовые кислоты).
Многие депрессоры и активаторы одновременно являются и регуляторами среды. К ним в первую очередь относятся сернистый натрий, жидкое стекло, железный купорос и др.
Изменение щелочности пульпы часто происходит и за счет минерального состава флотируемой руды. Окисленные руды обычно создают кислую среду, а при наличии в руде карбонатов щелочноземельных металлов пульпа приобретает щелочную реакцию.
Дата добавления: 2020-11-18; просмотров: 844;











