Реагенты – собиратели
Для флотации различных минералов применяют различные собиратели, которые можно классифицировать во-первых по их способности диссоциировать в водной среде на ионы, а во-вторых, по типу иона, гидрофобизирующего поверхность минерала.
Реагенты собиратели клсссифицируются на две большие группы ионогенные и неионогенные прежде всего по способности диссоциировать в водной среде на ионы ( рис. 155).

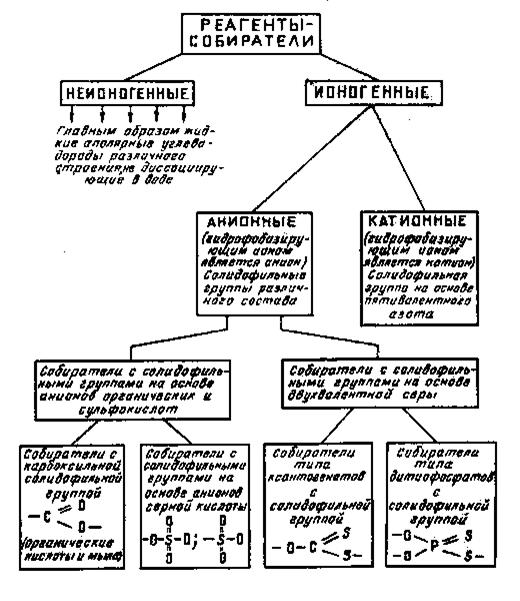
Рис. 155. Классификация реагентов -собирателей
Ионогенные собиратели в свою очередь подразделяются на анионные и катионные в зависимости от вида гидрофобизирующего иона. Неионогенные собиратели представлены аполярными углеводородными жидкостями, которые нерастворимы в воде.
 Анионные с
Анионные с  обиратели представлены тремя большими группами: сульфгидрильные собиратели, получаемые на основе двухвалентной серы. К ним относятся ксантогенаты, имеющие в составе полярной части группу
обиратели представлены тремя большими группами: сульфгидрильные собиратели, получаемые на основе двухвалентной серы. К ним относятся ксантогенаты, имеющие в составе полярной части группу  и дитиофосфаты, содержащие группу
и дитиофосфаты, содержащие группу
 |
Большая группа анионных собирателей представлена соединениями на основе карбоновых кислот и поэтому называемых карбоксильными. В своем составе анионы этих собирателей имеют полярную группу
Собиратели производные серной кислоты, представлены алкилсульфатами и алкилсульфонатами, в состав аниона которых входят группы и
и
Катионные собиратели, гидрофобизирующим ионом которых является катион, применяются реже анионных. К ним относятся высшие жирные амины и их соли, четвертичные аммониевые основания.
Большинство представленных реагентов-собирателей имеют структуру гетерополярной молекулы, состоящей из полярной и аполярной групп. Полярная группа такой молекулы способна взаимодействовать с водой, а аполярная, представляющая углеводородный радикал, не взаимодействует с диполями воды и является гидрофобной.
Типичным примером такого собирателя с гетерополярной молекулой является олеиновая кислота С17Н33СООН, структурная формула которой представлена на рис.156

Рис. 156. Структура молекулы олеата натрия
При адсорбции таких собирателей на поверхности минерала солидофильная часть полярной группы ( у олеиновой кислоты это СОО–) ориентируется к поверхности минерала и взаимодействует с ней, образуя прочное химическое соединение ( рис. 157). Аполярная группа, представленная у олеиновой кислоты углеводородным радикалом С17Н33, направлена в водную фазу и, являясь гидрофобной, гидрофобизирует поверхность минерала, обеспечивая прилипание его к пузырькам воздуха и флотацию.

Собиратели, содержащие двухвалентную серу. При флотации руд цветных металлов наибольшее применение нашли собиратели производные дитиоугольной и дитиофосфорной кислот. Типичным представителем таких собирателей являются ксантогенаты, представляющие собой соли ксантогеновых кислот ( кислых эфиров дитиоуголной кислоты) с общей формулой
Рис. 157.. Схема адсрбции олеиновой
кислоты на поверхности минерала
Где R – углеводородный радикал, например, этил, амил, бутил, изопропил и др;
Ме – металл ( К или Na)
Название ксантогенат получает по углеводородному радикалу, являющемуся остатком спирта, и по металлу, на основе которого он получен. Например, ксантогенат С4Н9OСSSKназывается бутиловым ксантогенатом калия.
 Производство ксантогенатов основано на реакции взаимодействия между сероуглеродом СS2 и спиртом в щелочной среде
Производство ксантогенатов основано на реакции взаимодействия между сероуглеродом СS2 и спиртом в щелочной среде
Наиболее часто в практике флотации применяются бутиловый С4Н9ОСS2K, этиловый С2Н5ОСS2K и изопропиловый i- C3H7 OCS2K ксантогенаты.
Ксантогенаты представляют собой кристаллы желтого цвета, обладающие специфическим устойчивым запахом, хорошо растворимые в воде, где они диссоциируют на ионы
ROCS2K ↔ ROCS2¯ + K
В кислой среде ксантогенаты гидролизуются по реакции
ROCS2K + Н2О → ROCS2Н + КОН → ROH + CS2 + KOH
Наиболее быстро разложение ксантогената осуществляется при рН < 5 и при повышенной температуре. Поэтому применение их ограничивается щелочной средой. Ксантогенаты, являясь восстановителями, хорошо окисляются в водных растворах до диксантогенида,

окисление которого в присутствии сульфидных минералов значительно ускоряется.
Собирательная активность ксантогенатов растет с увеличением длины углеводородного радикала, но при этом уменьшается его растворимость и избирательность.
Расход ксантогената обычно составляет от 10 до 100 г/т перерабатываемой руды. В зависимости от расхода он подается в процесс в виде 2…10%- ного водного раствора. Часто во флотацию подается сочетание ксантогенатов, например, бутилового и изопропилового, что значительно повышает собирательные свойства реагентов и извлечение сульфидных минералов.
Ксантогенаты могут служить исходным сырьем для получения реагентов-собирателей, которые применяются, например, медно – молибденовых руд. Так при взаимодействии изопропилового ксантогената с метиламином образуется тионокарбамат, известный под названием ДТК
Диалкилдитиофосфаты или аэрофлоты являются тионопроизводными эфиров диалкилфосфиновых кислот, у которых атомы кислорода замещены на серу. Они получаются в результате взаимодействия пятисернистого фосфора со спиртами при температуре 50…80˚С. К полученной дитиофосфорной кислоте для нейтрализации добавляют поташ, сода или углекислый аммоний
Полярная группа дитиофосфатов аналогична полярной группе ксантогенатов, только в состав ее входит не углерод, а фосфор, т.е.
или (RO)2PS2Ме,
где R – алифатический радикал, Ме – К+, Na+ или NH+ 4.
При флотации руд цветных металлов спиртовые ( бутиловый, изобутиловый, изопропиловый и этиловый) дитиофосфаты применяются в виде 5…10% - ных водных растворов. Они являются более селективными собиратели, нежели ксантогенаты при переработке медно-пиритных, медно-цинково-пиритных руд, т.к. являются слабыми собирателями для пирита, иногда их применяют в сочетании с ксантогенатыми без подачи вспенивателя, потому что ониобладают пенообразующими свойствами.
Оксигидрильные собиратели – это ионогенные собиратели с карбоксильной группой, имеющие общую формулу R–COOH, содержат одну или несколько оксигрупп –ОН и групп =О. Эти собиратели называются карбоксильными, т.к. в полярной части их молекулы имеется карбоксильная группа –СОО–.
Наиболее распространенными карбоксильными собирателями являются жирные кислоты и их соли, называемые мылами. Они содержаться в растительных маслах и почти во всех животных жирах.
Физико-химичсские и флотационные свойства карбоновых кислот зависят от числа карбоксильных групп, их расположения в молекуле, величины и строения углеводородного радикала. Так их растворимость щелочных солей их в воде уменьшается с увеличением молекулярной массы.
Углеводородный радикал R в этих реагентах может быть представлен двумя видами углевлдородов: насыщенными ( предельными) с общей формулой СnH2n+1 и ненасыщенными ( непредельными) – СnH2n-1. К первым относятся, например, пальмитиновая кислота С15Н31СООН, стеариновая кислота С17Н35СООН и др.
Типичным представителем ненасыщенных жирных кислот является олеиновая кислота С17Н33СООН, имеющая одну двойную связь
Олеиновая кислота и ее соль (олеат натрия) являются одними из основных реагентов – собирателей для несульфидных минералов ( барита, флюорита, кальцита, фосфорита, шеелита, апатита и др. Одним из недостатков олеиновой кислоты и олеата натрия является из малая селективность. Олеиновая кислота труднорастворима в воде.
Со щелочами олеиновая кислота образует мыло ( олеат натрия или калия), которое уже хорошо растворяется в воде.
В водной среде олеат натрия подвергается гидролизу
С17Н33СООNa + H2O→ C17H33COOH + NaOH
Получаемая в результате гидролиза олеиновая кислота частично диссоциирует на ионы
C17H33COOH → C17H33COO- +Н+
Форма собирателя в жидкой фазе пульпы ( ионная или молекулярная) зависит от рН жидкой фазы. Обычно флотации оксигидрильными собирателями осуществляется при рН > 7, когда эти собиратели находятся в пульпе в основном в ионной форме.
Техническая олеиновая кислота, которая применяется в практике флотационного обогащения помимо олеиновой кислоты ( 40%) содержит линолевую С17Н31СООН, пальмитиновую, стеариновую кислоты и до 10% нафтеновых кислот. Сумма жирных кислот в технической олеиновой кислоте должна быть не менее 92%.
Олеиновая кислота применяется при температуре пульпы выше 16˚С, т.к. при более низких температурах снижается ее дисперсность и ухудшаются собирательные свойства, а расход увеличивается более чем в 2 раза, который в обычных условиях составляет 0,15…1 кг/т руды.
В процесс флотации олеиновая кислота подается обычно в тонкодисперсном состоянии в виде эмульсии с керосином ( 1:1 или 1:2) или в виде мыла после омыления щелочью.
Олеиновая кислота является довольно дефицитным и дорогим реагентом, поэтому она часто успешно заменяется более дешевыми собирателями. В качестве таких заменителей используется сырое таловое масло, дистиллированное таловое масло, жирнокислотная фракция талового масла.
Сырое талловое масло состоит из смеси жирных кислот (35…40%), смоляных кислот ( 40…59%) и органических неомыляемых веществ. Жирные кислоты представлены олеиновой ( 32…38%), линолевой ( 58%) и линоленовой (4%) кислотами.
Дистиллированное талловое масло, которое получается при вакуумной разгонке сырого талового масла, содержит до 60% жирных кислот, в жирнокислотной фракции таллового масла содержание жирных кислот повышается до 90%, а содержание смоляных кислот снижается до 2%.
Эти собиратели обладают высокой флотационной активностью и с успехом заменяют олеиновую кислоту в виде эмульсии с содой и кросином.
Среди других заменителей олеиновой кислоты необходимо отметить нафтеновые кислоты, которые выделяются при перегонке нефти. Они отличаются от других карбоновых кислот структурой изоциклического углеводородного радикала, например
СН2–СН2
СН· С
СН2–СН2
Наиболее флотоактивной является фракция, выделяемая дистилляцией при температуре 1200С, которая содержит 68…76% нафтеновых кислот. При флотации расход их в 2…3 раза выше расхода олеиновой кислоты, но стоимость в 9…10 раз ниже. При обработке нафтеновых кислот щелочью получается нафтеновое мыло, которое называется мылонафтом и содержит не менее 43% нафтеновых кислот.
Нафтеновые кислоты и мылонафт применяются для флотации при температурах пульпы менее 10˚С. Они имеют меньшую чувствительность к солям жесткости в жидкой фазе пульпы, обладают пенообразующими свойствами и могут заменять олеиновую кислоты при флотации окисленных минералов.
Среди других заменителей олеиновой кислоты можно отметить синтетические жирныекислоты (СЖК), которые выделяются из натуральных и синтетических парафинов методом ступенчатой диссоциации. Эти кислоты являются более слабыми собирателями по сравнению с олеиновой кислотой, но значительно селективные и обладающие хорошими пенообразующими свойствами.
К собирателям анионного типа относятся реагенты – органические производные серной кислоты – алкилсульфаты и алкилсульфанаты.
Алкилсульфаты или соли сульфоэфиров вторичных спиртов имеют формулу ROSO3Na, где R – углеводородный радикал, содержащий 4…14 атомов углерода. Алкилсульфаты получают при сульфировании 66%-ной серной кислотой некоторых животных жиров и углеводородов нефти, хорошо растворимых в воде. Алкилсульфаты получают также при действии серной кислоты на высшие спирты С10 –С16 по реакции
ROH + H2SO4 → ROSO3H + H2O
Затем полученные сульфоэфиры нейтрализуют едким натром с получением алкилсульфата натрия
ROSO3H + NaOH → ROSO3Na + + H2O
Алкилсульфаты обладают высокой поверхностной активностью и входят в состав многих моющих средств. Они являются хорошими собирателями для окисленных минералов, сохраняют селективность в кислых средах и не чувствительны к солям жесткости. Некоторые из этих собирателей являются хорошими пенообразователями, пептизаторами шламов и эмульгаторами.
Алкилсульфонаты или соли сульфокислот отличаются от алкилсульфатов тем, что в них углерод радикала связан непосредственно с атомом серы сернокислотного остатка, т.е. R – SO3H, где R – алкильный радикал, содержащий в основном 11…18 атомов углерода.
Алкилсульфонаты получаются при взаимодействии углеводородов, карбоновых кислот и других органических соединений с верной кислотой. Содержат не менее 40% натриевых солей алкилсульфоновых кислот, Применяются в виде водных растворов. Они являются слабыми собирателями, обладают хорошими пенообразующими свойствами, растворимы в воде. Используются при флотации несульфидных минералов, часто в сочетании с карбоксильными собирателями.
Среди других анионных собирателей в последнее время все более широкое распространение особенно при флотации руд редких металлов находят производные фосфорных и арсоновых кислот, а также алкилгидраксамовых кислот и их солей.
Представителем последних является анионный комплексообразующий собиратель ИМ – 50 – водный раствор натриевых солей алкилгидраксамовых кислот, имеющих структуру
R– C= O, где R – C6H13…С8Н17.
Эти соли выделяются при обработке метиловых эфиров карбоновых кислот гидраксиламинсульфатом в щелочной среде в присутствии ПАВ. Вначале при взаимодействии жирных кислот с метиловым спиртом в присутствии серной кислоты выделяются метиловые эфиры
RCOH + CH3OH 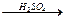 R–COOCH3 + H2O
R–COOCH3 + H2O
А затем в результате реакции этих эфиров с сернокислым гидраксиламином в присутствии щелочи при 20…22˚С получается раствор натриевой соли гидроксамовых кислот
Реагент ИМ-50 в кислой форме содержит 60…70% гидроксамовых кислот, 15…20% жирных кислот и 20…30% влаги. Применяется он в виде 1…4%-ных водных растворов. Реагент является хорошим собирателем перовскита, пирохлора и других ниобиевых минералов при рН 6,5…7 , а также касситерита при рН 5,5…2,0. Реагент ИМ-50 совсем не флотирует силикатные минералы, но очень чувствителен к присутствию в пульпе шламов и ионов таких металлов, как железо.
Катионные собиратели относятся к ионогенным и отличаются от анионных тем, что гидрофобизирующим ионом у них является катион, т.е. положительно заряженный ион. Катиооные собиратели являются аминами- органическими производными аммиака, в которых один или все атомы водорода замещены углеводородными радикалами. При замещении одного атома водорода получаются первичные амины R –NH2, двух атомов – вторичные амины R2NH и при замещении трех атомов водорода образуются третичные амины R2–N–R. В зависимости от природы радикала амины бывают алифатические, циклические и гетероциклические.
В практике флотации наибольшее применение нашли первичные алифатические амины, углеводородный радикал которых содержит от 10 до 18 атомов углерода, их соли и соли замещенных четвертичных аммониевых оснований.
Амины, в углеводородной цепи которых содержится более 6…8 атомов углерода в воде нерастворимы, поэтому они применяются в виде хлористоводородных или уксуснокислых солей, например, NH4Cl или RNH3Cl . В щелочной среде амины образуют соединения с гидроксильной группой RNH3OH.
Четвертичные аммониевые основания образуются при замещении в группе аммония всех четырех атомов водорода. Примером может служить бромистый цетилтриметиламмоний
Эти реагенты в кислой среде диссоциируют на ионы и находятся преимущественно в ионной форме, а в щелочной среде – в молекулярной. Поэтому они могут закрепляться на минералах как в ионной, так и в молекулярной форме.
Применяются катионные собиратели главным образом при флотации силикатных минералов- полевых шпатов, кварца, слюд, при флотации литиевых, бериллиевых минералов, а также при флотации ионов и молекул.
Наиболее широкое распространение России нашли катионные собиратели АНП и ИМ-11.
Катионный собиратель АНП ( аминонитропарафин), имеющий формулу С14Н29NH3Cl, получается при обработке 55…65%-ной азотной кислотой при температуре 135…145˚С мягких парафинов. Полученные жидкие продукты обрабатывают метанолом и переводят их в гидрохлориды соляной кислотой или хлористым аммонием.. Состоит он из хлоргидратов первичных аминов ( не менее 75%) с радикалами, имеющими 14…15 атомов углерода. Применяется он в виде 1…2%-ного раствора при расходе 0,05…0,25 кг/. Обладает пенообразующими свойствами. Реагент АНП может применяться при флотации кварца, слюд, полевых шпатов, пирохлора, берилла, танталит-колумбита, железных минералов, литиевых, бериллиевых минералов и др.
Катионный собиратель ИМ-11 ( С13Н27NH3Cl) получается при обработке смеси предельных углеводородов, содержащих 13…16 атомов углерода, газообразным хлором, после чего хлорированные углеводороды обрабатываются аммиаком в этиловом спирте с получением аминов. Состоит реагент ИМ-11 из хлористоводородных солей первичных и вторичных аминов. Может применяться для тех же целей, что и реагент АНП.
В США успешно применяется катионный собиратель лауриламин С12Н25NH2 , выделяемый из жирных кислот кокосового масла. Реагент плохо растворяется в воде, поэтому применяется в виде гидрохлоридлауриламина С12Н25NH3Cl. Обладает также пенообразующими свойствами.
Неионогенные или аполярные собиратели в отличие от гетерополярных не диссоциируют на ионы и нерастворимы в воде. Они не содержат полярные группы, поэтому не взаимодействуют с диполями воды
Аполярные собиратели – это углеводородные жидкости, выделяемые при переработке нефти. Различный химический состав перерабатываемых нефтей обуславливает непостоянство состава продуктов их переработки.
Применяются аполярные собиратели при флотации минералов, обладающих природной гидрофобностью – молибденита, угля, серы, графита, алмазы и др. Они используются также при флотации силикатов, карбонатов и оксидов в сочетании с жирными кислотами, а для флотации сульфидов в сочетании с ксантогенатами.
В практике флотации наиболее широко применяются такие углеводородные масла, как керосин, трансформаторное, машинное масло, смазочные нефтяные масла, смолы и продукты переработки угля, древесины, смолы, сланца и торфа.
Керосин осветлительный – это смесь предельных углеводородов, выделяемых при температуре 150…300˚С. В керосине содержится от 20 до 50% парафиновых углеводородов, от 30 до 80% нафтеновых соединений. Не обладает пенообразующими свойствами, а наоборот, снижает объем пены и ее стабильность, поэтому применяется для гашения обильной пены.
Трансформаторное масло получают при перегонке мазута, образовавшегося при обработке нефти. После очистки серной кислотой оно нейтрализуется щелочью.
Ветлужское масло выделяется при газификации древесины в виде тяжелой фракции перегонки газогенераторной смолы. В нем содержится до 40% высокомолекулярных фенолов, поэтому масло может применяться в качестве пенообразователя.
Механизм действия реагентов-собирателей. Закрепление реагентов-собирателей на поверхности минеральных частиц происходит при адсорбции их на границе раздела твердой (минерал) и жидкой (вода)фазы. Причем адсорбция может быть как химическая (хемосорбция), так и физическая. Основное различие между этими типами адсорбции заключается в характере сил, связывающих адсорбированное соединение с поверхностью минерала. При химической сорбции или хемосорбции адсорбированные молекулы или ионы связаны с минералами химическими связями. Энергия связи адсорбированной молекулы с поверхностью минерала достигает 1 эВ ( 1 эВ = 23,053 ккал/моль). При физической адсорбции силы, связывающие адсорбируемое соединение с поверхностью минерала являются электростатическими, т.е. молекулярными силами сцепления ( силы Ван-дер-Ваальса) и энергия связи при этом виде сорбции составляет лишь 0,01…0,1 эВ. Кроме того, при физической адсорбции адсорбируемую молекулу и минерал необходимо рассматривать как две независимые системы, в то время как при хемосорбции минерал и прочно связанные с ним адсорбированные молекулы представляют собой единую систему. Адсорбция в этом случае завершается образованием нового химического поверхностного соединения адсорбированных ионов с ионами кристаллической решетки минералов.
При физической адсорбции выделяется небольшое количество теплоты ( около 0,4…2 ккал/моль), в то время как при химической адсорбции теплота адсорбции достигает 20…30 ккал/моль. Кроме того. при физической адсорбции не закрепляется прочно на участках минеральной поверхности и легко десорбируется. Химическая сорбция необратима, адсорбируемое вещество закрепляется на активных центрах поверхности минерала. Физическая сорбция неспецифична, природа поверхности твердой фазы и состав адсорбируемого вещества оказывают незначительное влияние на полноту адсорбции, которая определяется главным образом концентрацией адсорбируемого вещества.
Химическая сорбция избирательна, т.к. зависит от химического сродства адсорбируемого вещества к поверхности твердого тела (минерала).
Форма взаимодействия собирателя с минералом определяется состоянием реагента и поверхности минерала в пульпе. Если реагент диссоциирует на ионы и на поверхности минерала закрепляется анион или катион, то адсорбция будет осуществляться за счет химической связи между ионами собирателя и минерала, т.е. будет ионной. Неионогенные собиратели адсорбируются, как правило, в молекулярной форме за счет физической адсорбции.
Современные представления о механизме сорбции реагентов – собирателей можно рассмотреть на примере наиболее часто применяемых и хорошо изученных собирателей – ксантогената – собирателя для сульфидных минералов и олеиновой кислоты – собирателя окисленных минералов.
Необходимым условием образования гидрофобного покрытия на поверхности минералов необходимо, чтобы анион собирателя образовывал с катионом минерала более прочное соединение, чем существующее на его поверхности .
Взаимодействие ксантогената с поверхностью сульфидных минералов происходит при химической адсорбции аниона ксантогената с образованием прочной химической связи с катионом кристаллической решетки минерала, т.е. с образованием ксантогената металла. Кроме того в образовавшемся сорбционном покрытии помимо химически закрепившегося собирателя присутствует физически сорбированный собиратель – продукт окисления ксантогената – диксонтогенид.
Большинство сульфидных минералов являются соединениями с полупроводниковыми свойствами. Свежеобнаженная поверхность этих минералов обладает электронной проводимостью n – типа. Поверхность неокисленного сульфидного минерала, на которой не адсорбировался кислород, имеет свободные электроны и на ней не может адсорбироваться отрицательно заряженный анион ксантогената..Поэтому, например, свежеприготовленный галенит, не подвергнутый процессу окисления, является гидрофобным и хорошо флотируется одним вспенивателем.
 Сульфидные минералы хорошо окисляются кислородом и на их поверхности образуются окисленные соединения, состав которых зависит от условий окисления. Например на поверхности галенита при окислении образуются поверхностные соединения PbSO4, PbS2O3, PbCO3 или НPO2. При окислении адсорбированный кислород связывает свободные электроны на поверхности минерала и поверхность приобретает дырочный тип проводимости ( р – тип). Продукты окисления сульфидов (
Сульфидные минералы хорошо окисляются кислородом и на их поверхности образуются окисленные соединения, состав которых зависит от условий окисления. Например на поверхности галенита при окислении образуются поверхностные соединения PbSO4, PbS2O3, PbCO3 или НPO2. При окислении адсорбированный кислород связывает свободные электроны на поверхности минерала и поверхность приобретает дырочный тип проводимости ( р – тип). Продукты окисления сульфидов ( 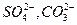 )
)  ,связанные с кристаллической решеткой минерала , замещаются анионом ксантогената с образованием сульфидо-ксантогената (Рис.158).
,связанные с кристаллической решеткой минерала , замещаются анионом ксантогената с образованием сульфидо-ксантогената (Рис.158).
Рис. 158. Схема состава сорбционного слоя ксантогенана на галените
При глубоком окислении сульфидных минералов образуются ксантогенаты металлов, которые отслаиваются с поверхности.
Неокисленная сульфидная поверхность может взаимодействовать с ксантогенатом, образуя ксантогенат свинца, однако это может произойти только при высокой концентрации собирателя.
Одновременно с сорбцией ионов ксантогената на поверхности минералов происходит физическая сорбция собирателя в молекулярной форме- в виде продукта окисления ксантогената – диксантогенида. Присутствие диксантогенида в сорбционном слое оказывает существенное влияние на флотируемость сульфидных минералов. Количество сорбированного собирателя в виде диксантогенида при флотации сульфидного минерала обычно составляет около 10…20% от общего количества сорбированного собирателя.
Таким образом, наиболее эффективная флотация сульфидных минералов происходит при одновременном присутствии в адсорбированном слое на поверхности минералов как химически закрепившегося ксантогената, так и химически сорбированных молекул диксантогенида. Соотношение между этими двумя формами определяется рН жидкой фазы пульпы, концентрацией собирателя и состоянием поверхности сульфидного минерала.
При взаимодействии олеиновой кислоты с поверхностью окисленных минералов анион олеиновой кислоты С17Н33СОО- гидрофобизирует поверхность минерала, закрепляясь на ней полярной группой СОО-. Углеводородный радикал С17Н33, являясь аполярной группой,, ориентируется в водную фазу, обеспечивая гидрофобность поверхности ( см. рис.157).
Анион олеиновой кислоты химически взаимодействует с катионом минерала, образуя на его поверхности соответствующее труднорастворимое мыло, например, на поверхности кальцита или флюорита кальциевое мыло по реакции
СаСО3 + 2С17Н33СООН = (С17Н33СОО)2Са + Н2СО3
который обеспечивает гидрофобизацию поверхности минерала и его флотацию.
Закрепление оксигидрильных собирателей на поверхности несульфидных минералов зависит также от состояния поверхности минерала, структуры реагентов и от условий , в которых эти реагенты применяются. Состояние таких жирнокислотных собирателей, как олеиновая кислота и олеат натрия в пульпе зависит от концентрации водородных ионов ( рН). В зависимости от величины рН они могут находится в виде молекул или в вимде диссоциированных ионов, поэтому адсорбция может осуществляться в ионной форме ( химическая адсорбция) и в молекулярной форме ( физическая адсорбция). Обычно адсорбированный гидрофобный слой на поверхности минералов представлен этими двумя формами: химически сорбированным олеатом металла и физически сорбированными молекулами олеиновой кислоты.
Взаимодействие катионных собирателей с поверхностью минералов определяется прежде всего условиями, в которых они применяются, т.е. состоянием амина в водном растворе. Например, лауриламин при рН до 10 находится в растворе преимущественно в ионной форме и закрепляется в этих условиях на поверхности , например, кварца химически с образованием комплексного соединения. При рН более 11 лауриламин присутствует в растворе в виде молекул, которые сорбируются на поверхности минерала за счет физической адсорбции. Возможно также закрепление амина на поверхности минерала путем связывания ионов или молекул амина с водородом гидроксила у силикатов или водорода амина с серой у сульфидов. Характерной особенностью катионных собирателей является непрочность их закрепления на минералах. Считается, что флотируемость минералов катионными собирателями зависит в основном от плотности адсорбированного слоя амина и не зависит от характера этого слоя, образованного ионами или молекулами.
Закрепление аполярных реагентов на поверхности минералов происходит за счет физической сорбции. Капельки эмульсии аполярного собирателя закрепляются на минерале, и если этих капелек будет много, то они, сливаясь друг с другом, образуют на поверхности минерала сплошную гидрофобную пленку. Образование такой пленки зависит от степени гидратации самой поверхности минерала, которую можно изменять, применяя поверхностно-активные вещества. Эти вещества снижают гидратированность поверхности и создают благоприятные условия для адсорбции аполярного собирателя.
Дата добавления: 2020-11-18; просмотров: 1115;











