Гальванічні покриття
3.1.Основные закономірностей
Гальванічний метод осадження захисних металевих покриттів набув дуже широке поширення в промисловості. В порівнянні з іншими способами нанесення металлопокритів він має ряд серйозних переваг: високу економічність (захист металу від корозії досягається вельми тонкими покриттями), можливість отримання покриттів одного і того ж металу з різними механічними властивостями, легку керованість процесу (регулювання товщини і властивостей металевих опадів шляхом зміни складу електроліту і режиму електролізу), можливість отримання сплавів різноманітного складу без застосування високих температур, хороше зчеплення з основним металом і ін.
Недолік гальванічного методу - нерівномірність товщини покриття на виробах складного профілю.
Електрохімічне осадження металів проводять в гальванічній ванні постійного струму. Виріб, що покривається металом, завішують катод. Як аноди використовують пластини з металу (розчинні аноди) або з матеріалу, нерозчинного в електроліті (нерозчинні аноди).
Обов'язковий компонент електроліту - іон металу, осідаючий на катоді. До складу електроліту можуть також входити речовини, що іідвищують його електропровідність, регулюючі протікання анодного процесу, забезпечує постійність рН, поверхнево-активні речовини, що підвищують поляризацію катодного процесу, блиськоутворюючі і добавки і ін.
Гальванічне осадження металу відбувається в результаті електрохімічної реакції розряду гидратованих іонів металу на катоді і входження атомів, що утворилися, до складу кристалічних грат покриття.
Електроосадження металів протікає по стадіях, найважливішими з яких є:
1) доставка іонів металу, що розряджаються, з об'єму електроліту
до поверхні катода здійснюється в основному завдяки дифузії і конвекції;
2) розряд гидратованих іонів металу, включає часткову або повну дегідратацію іонів і адсорбцію частинок, що розрядилися, на електроді;
3) переміщення (дифузія) частинок, що розрядилися, по поверхні електроду до місць кристалізації (місцям зростання), входження атомів а кристалічні грати, освіту і зростання кристалічних зародків.
Спочатку виникають кристалічні зародки, які потім ростуть унаслідок приєднання атомів металу, що розрядилися. Структура гальванічного осаду визначається співвідношенням швидкостей утворення кристалічних зародків і їх зростання. Чим вища відносна швидкість утворення зародків, тим більше дрібнозерниста структура покриття.
Кількість металу пропорційна кількості минулої через електрод електрики. Тому товщину покриття визначають на підставі закону Фарадея:
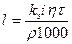
де l - товщина покриття, мм;
kэ- електрохімічний еквівалент, г/А.ч;
h - вихід металу по струму, % ;
i- катодна густина струму, А/дм2;
r - густина металу покриття, г/см3;
t - тривалість електролізу, ч.
3.2. Підготовка поверхні перед нанесенням покриттів
Отримання покриттів, міцно зчеплених з основним металом і з хорошим зовнішнім виглядом, неможливе без ретельної підготовки поверх нести. Перед нанесенням покриттів деталі повинні бути очищені від окалини, іржі, оксидів, жирових забруднень. Навіть абсолютно чисті за зовнішнім виглядом деталі необхідно знежирити і піддати травленню.
Травлення видалення поверхневих оксидів хімічним чи єлетрохимічним способом.
Склади розчинів для того, що хімічного труїть вибирають залежно від природи металу. Труїть чорних металів найчастіше про водять в сірчаній і соляній кислотах. Для боротьби з перетруюванням і наводнюванням (той, що хімічне труїть в кислотах супроводжується виділенням водню) в травильні розчини додають спеціальні речовини - інгібітори труїть. Їх введення уповільнює або припиняє розчинення металу, не знижуючи швидкості розчинення оксидів.
Той, що труїть алюмінію і його сплавів проводять в 5-10-ном розчині НСl або 10-15-ном розчині NaОН з додаванням 30 г/л NaCl.
Той, що електрохімічне труїть заснований на електрохімічному розчиненні металу і механічному відриві оксидів міхурами газу, що виділяється.
3.3. Нанесення гальванічних покриттів
У машинобудуванні для захисту виробів від корозії використовують гальванічне осадження багатьох металів: цинку, кадмію, нікелю, хрому, олова, свинцю, золото, срібло і ін. Застосовують також електролітичні сплави, наприклад Cu – Zn, Cu – Sn, Sn –Bi і багатошарові покриття.
Найефективніше (електромеханічно і механічно) захищають чорні метали від корозії анодні покриття цинком і кадмієм.
Порівняльно висока стійкість цинку в атмосфері, його доступність і дешевизна забезпечили йому дуже широке застосування для захисту сталевих листів, дроту, кріплення деталей машин, водопровідних труб, резервуарів і ін. У морських умовах цинкові покриття руйнуються відносно швидко.
Кадмій дорожчий за цинк, але більш стійкіший в кислих і нейтральних середовищах, розчинах хлоридів. У атмосфері промислових міст кадмієві покриття менш стійкі, ніж цинкові. Тому кадміювання частіше використовують для захисту чорних і кольорових металів в умовах морського клімату або при дії рідкого середовища, що містить хлориди.
Осадження цинку і кадмію проводять з простих і комплексних електролітів. Перші як продуктивніші але володіючи гіршою розсіюючою здатністю, застосовують для нанесення металу на вироби простої форми (сталеві листи, дріт і ін.), другі - при осадженні на вироби складного профілю, де важлива рівномірність покриття.
Прикладами простих електролітів цинкування і кадміювання, що працює при кімнатній температурі, є наступні, г/л:
ZnSO4 . 7H2O 200 – 250; Na2SO4 . 10H2O 50 – 100;
Al2(SO4)3 . 18H2O 20 – 30; декситрін 10; pH = 3.5¸4.5;
Густина струму 1-4 А/дм2;
2) CdSO4 . 8/3H2O 40-60; (NH4)2SO4 30-40;
Al2(SO4)3 . 18H2O 25-30; желатину 0,5; pH = 2.5¸4.5;
Густина струму 1-4 А/дм2
Як комплексні електроліти частіше інших використовують ціаністі електроліти наступних складів, г/л:
1) ZnO 10-18; NaCN 20-30; NaOH 50-70; Na2S
0.5-5; густини струму 0,5-1 А/дм2;
2)CdO 25-40; NaCN 80-130; NaOH 20-30;
Na2SO4. 10H2O 40-60; густина струму 0,5-2 А/дм2
Дуже поширені нікелеві покриття. Їх широко застосовують для захисту виробів від корозії і для декоративної обробки в машинобудуванні, приладобудуванні, автомобільній, медичній, електронній промисловості, при виготовленні предметів побутового споживання. Нікелеві покриття вельми стійкі в атмосфері, розчинах лугів і деяких органічних кислот, що обумовлене сильно вираженою здібністю нікелю до пасивації в цих середовищах.
Оскільки нікель благородніший в порівнянні із залізом метал, то захист від корозії нікелевими покриттями можливий тільки за відсутності в них пір. Тому використовують або товсті покриття (25-35 мкм), або в поєднанні їх з іншими металами, наприклад, наносять підшаровуй мідь 25-30 мкм, а потім 10-15мкм нікелю.
Найчастіше нікелювання здійснюють з електроліту складу,
г/л: NiSO4. 7H2O 260-300; H3BO3 30-35; NiCl2.6H2O 40-60 з і вирівнюючих добавками блеcко-твірних (1,4-бутіндіола 0,12-0,16 г/л, сахарину 0,7-1,3 г/л, фталіміда 0,08-0,1 г/л).
Хромове покриття наносять з розчину, що містить CrO3 250 г/л,
H2SO4 2.5 г/л; густина струму 30- 80 А/дм2, температура процесу 40-70°С.
Залежно від величини густини струму і температури виходять блискучі і матові опади з різними механічними властивостями.
Через сильно виражену здібність до пасивації хром придбаває підвищену хімічну стійкість і є катодним покриттям по відношенню до сталі. Він добре чинить опір атмосферній корозії стійок в азотній кислоті, ряду органічних кислот, в розчинах багатьох солей, зокрема що містять сірку.
Хромування широко застосовують при виготовленні ріжучого інструменту, валів, осей циліндрів, двигунів, лопаток парових і водяних турбін і ін.
Олов'яні покриття застосовують головним чином для захисту від корозії в розчинах органічних кислот і солей, що містяться в харчових продуктах, а також від атмосферної корозії в приладобудуванні, де разом із захисними властивостями необхідно забезпечити паяємость вироби.
Олово наносять з сірчанокислих і лужних електролітів. Сірчанокислі електроліти містять сірчанокисле олово, сірчану кислоту і добавки поверхностно- активних речовин (клей, крезол, препарат ОС-20).
Процес електроосадження металів здійснюється в стаціонарна дзвонових, барабанних ваннах, на напівавтоматичних і автоматичних лініях.
Дата добавления: 2016-07-27; просмотров: 2484;











