Факторы, влияющие на ККМ
ККМ зависит от многих факторов, но прежде всего определяется строением углеводородного радикала, природой полярной группы, добавками в раствор различных веществ и температурой.
1. Длина углеводородного радикала R.
Для водных растворов – в гомологическом ряду для соседних гомологов отношение ККМ ≈ 3,2 имеет значение коэффициента правила Дюкло-Траубе. Чем больше R, тем сильнее понижается энергия системы при мицеллообразовании, поэтому, чем длиннее углеводородный радикал, тем меньше ККМ.
Способность к ассоциации проявляется у молекул ПАВ при R > 8-10 атомов углерода С. Разветвленность, непредельность, циклизация уменьшают склонность к МЦО и ↑ ККМ.
При R< 8 атомов С наблюдаются высокие числа ГЛБ (недостаточно выражено различие между полярными и неполярными частями).
Для органической среды при ↑ R повышается растворимость и ККМ ↑.
Сильнее всего ККМ в водных растворах зависит от длины углеводородного радикала: в процессе мицеллообразования понижение энергии Гиббса системы тем больше, чем длиннее углеводородная цепь ПАВ, т. е. чем длиннее радикал, тем меньше ККМ. Т.е. чем длиннее углеводородный радикал молекулы ПАВ, тем при меньших концентрациях достигается монослойное заполнение поверхности (Г¥) и тем ниже ККМ.
Исследования мицеллообразования показали, что образование ассоциатов молекул ПАВ происходит и в случае углеводородных радикалов, состоящих из 4 - 7 атомов углерода. Однако в таких соединениях недостаточно выражено различие между гидрофильной и гидрофобной частями (высокое значение ГЛБ). В связи с этим энергия агрегирования недостаточна для удержания ассоциатов - они разрушаются под действием теплового движения молекул воды (среды). Способность к мицеллообразованию приобретают молекулы ПАВ, углеводородный радикал которых содержит 8 - 10 и более атомов углерода.
2. Характер полярной группы.
В водных растворах ПАВ гидрофильные группы удерживают агрегаты в воде и регулируют их размер.
для водной среды в органической среде
RT lnKKM = a – bn 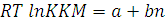
где a – постоянная, характеризующая энергию растворения функциональной группы (полярные части) 
в - постоянная, характеризующая энергию растворения, приходящуюся на одну группу –СН2.
Характер полярной группы играет существенную роль при МЦО. Ёе влияние отражает коэффициент a, однако влияние природы полярной группы менее значительно, чем длина радикала  .
.
При равном R то вещество имеет большую ККМ, у которого лучше диссоциирует его полярная группа (наличие ионногенных групп ↑ растворимость ПАВ), поэтому при равном радикале ККМИПАВ > ККМНИПАВ.
Наличие ионогенных групп увеличивает растворимость ПАВ в воде, поэтому для перехода ионогенных молекул в мицеллу выигрывается меньше энергии, чем для неионогенных молекул. Поэтому ККМ для ионогенных ПАВ обычно выше, чем для неионогенных, при одинаковой гидрофобности молекулы (числе атомов углерода в цепях).
Дата добавления: 2016-07-27; просмотров: 4192;











