Химические взаимодействия атомов и молекул
Отличия живой материи от неживой начинают проявляться на уровне химической организации, когда атомы объединяются в молекулы. За объединение атомов отвечают электромагнитные взаимодействия электронов внешних электронных орбиталей. При объединении внешние электроны разных атомов формируют общие молекулярные орбитали. На одной такой орбитали могут находиться один или два электрона. Состояние с одним электроном является неустойчивым. Атомы и молекулы в таком состоянии называются радикалами, они долго не существуют и энергично вступают в химические реакции. В результате образуются молекулы, в которых объединённые атомы удерживаются общими внешними орбиталями из спаренных электронов. Устойчивость пары объясняется тем, что электрон, будучи заряженной частицей, вращающейся вокруг собственной оси, создаёт магнитный момент, называемый спином. Магнитное поле, как известно, имеет определённую ориентацию в пространстве. Устойчивую пару образуют только электроны с противоположной ориентацией полей (спины антипараллельны). Два электрона с параллельными спинами (с одинаковой ориентацией магнитного поля) могут находиться только на разных орбиталях. Таким образом, одним из наиболее распространённых видов химической связи между атомами является связь в виде общей пары электронов. Если таких пар две, – связь называется двойной, если пар три, – тройной связью.
Количество атомов, которое может присоединить данный атом,определяется количеством внешних электронов, которые атом может отдать или принять до определённого предела. Таким пределом для атомов водорода и гелия являются 2 электрона на внешней орбитали, поэтому водород, имея в атомарном состоянии один электрон, при вхождении в молекулу может принять или отдать только один электрон. Для большинства остальных атомов насыщенное состояние на внешней орбитали образуется восемью электронами. Состояния с 2-мя электронами у гелия и 8-мью внешними электронами у атомов инертных газов являются очень устойчивыми, поэтому они практически, за редким исключением, не вступают в химические реакции, представляя собой одноатомные молекулы. Остальные же химические элементы, в зависимости от вида, могут принимать или отдавать от одного до семи электронов, образуя соответствующее количество связей.
Энергия, которая выделяется при присоединении электрона, называется сродством к электрону. Сродство определяет, в сторону какого атома будет происходить смещение электронов.
Атомы с 1-3 внешними электронами имеют низкое сродство к электронам, склонны их отдавать, превращаюясь в положительно заряженные ионы (катионы). Такие атомы относятся к металлам.
Атомы с 6-7 внешними электронами склонны принимать электроны, превращаясь в анионы, имеют высокое сродство и являются неметаллами. Атомы с 4-5 внешними электронами обычно являются амфотерными, т.е. могут проявлять свойства как металлов, так и неметаллов.
Процесс присоединения электрона называется восстановлением, а отдающее электрон вещество называется восстановителем. Аналогично процесс потери электрона называется окислением, а забирающее электрон вещество – окислителем.
Химическая связь между явным окислителем и восстановителем, при которой из-за полного смещения электронов в сторону одного атома образуются ионы, называется ионной. Примером является хлорид натрия Na+Clˉ. Химическая связь неметаллов образуется без смещения электронов или с малым смещением и называется ковалентной,например, ацетилен Н-С≡С-Н.
Если в молекуле существует пара атомов с заметными различиями в сродстве к электрону, то в результате смещения электронов один атом оказывается с пониженной плотностью электронов и получает некоторый положительный заряд без образования ионной связи. Связь остаётся ковалентной. При этом второй атом соответственно получает некоторый отрицательный заряд. Эти заряды заставляют ориентироваться молекулы так, что разноимённые заряды оказываются рядом и между молекулами образуется слабая связь, которая в десятки раз слабее ковалентной. Одним из атомов в таких парах обычно является водород, поэтому такая связь получила названиеводородной. Вторым атомом должен быть неметалл с высоким сродством к электрону (обычно О или N). Примером действия водородных связей является вода, молекулы которой образуют крупные агрегаты -кластеры (рис 3.2).
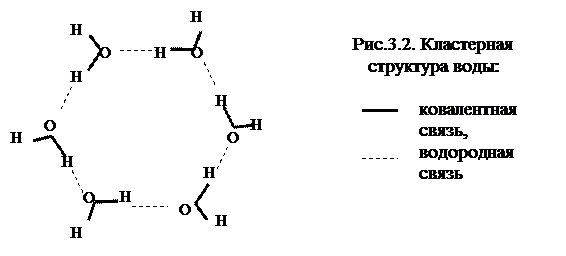
Водородные связи не дают молекулам воды разлететься и превратиться в газ. Это делает воду жидкостью, в то время как другие трёхатомные молекулы из неметаллов (СО2, Н2S, SO2, NO2) обычно являются газами. Водородные связи могут возникать и между разными частями одной крупной молекулы.
Химические реакции между молекулами происходят в результате их соударений, обусловленных тепловым движением. Чем выше скорость молекул (больше температура) и чем выше концентрация (количество молекул в единице объёма), тем больше скорость превращения веществ. Скорость реакции может также многократно увеличиваться при действии особых молекул - катализаторов, которые в результате реакции остаются неизменными. Роль катализаторов состоит в том, что они во время столкновений молекул ориентируют их в пространстве наилучшим образом.
Дата добавления: 2020-10-25; просмотров: 481;











