Титранти, їх приготування та стандартизація
Робочими розчинами кислотно-основного титрування є розчини сильних кислот і лугів, які швидко і кількісно реагують з речовинами, здатними вступати в реакції нейтралізації. Найчастіше готують титровані розчини хлоридної або сульфатної кислот. Ці розчини є стійкими. Як робочі розчини лугів використовують розчини гідроксидів Натрію, Калію, Барію, які є стійкими при зберіганні без доступу повітря у пластиковому посуді. У скляному посуді розчини лугів мутніють. При контакті розчинів лугів з вуглекислим газом повітря утворюються відповідні гідрокарбонати або карбонати.
Такі титранти є розчинами з установленим титром. Як первинні стандарти для встановлення точної концентрації розчинів кислот використовують Na2B4O7·10H2O або Na2CO3. Еквівалент установочної речовини визначають виходячи з конкретної реакції її з кислотою.
Розчини лугів стандартизують за допомогою оксалатної кислоти H2C2O4 ·2H2O або калій гідрогенфталату KHC8H4O4.
Крім первинних стандартів можна використовувати вторинні – титровані розчини кислот або лугів.
§ 41. Визначення кінцевої точки титрування.
Кислотно – основні індикатори
При титруванні кислотами та основами застосовують різні методи визначення точки еквівалентності. Частіше застосовують різного роду органічні кислоти, які змінюють своє забарвлення в залежності від рН розчину
Властивості кислотних індикаторів характеризуються рівновагою;
HІnd ↔ H+ + Ind–
Молекулярна форма (кислотна) HІnd відрізняється своїм забарвленням від йонної (сольової). Важливою характеристикою індикатора як кислоти є його константа дисоціації:
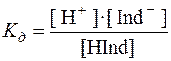
Для основних індикаторів, які є похідними амоніаку і в загальному вигляді мають формулу R-NH2, зміна забарвлення обумовлена рівновагою R-NH2+H+↔R-NH3+. Молекулярна (основна) форма індикатора R-NH2 має інше забарвлення в порівнянні з йонною (сольовою).
Всі залежності кислотних індикаторів такі ж як і основних, тому ознайомимось більш детально з властивостями кислотних індикаторів.
Інтервал переходу забарвлення індикатора.Зміна забарвлення кислотного індикатора обумовлена порушенням рівноваги HІnd ↔
H+ + Ind– при зміні рН розчину.
Якщо відома константа дисоціації індикатора, то можна завжди розрахувати умови, при яких даний індикатор змінює своє забарвлення.
Як приклад розглянемо метилоранж.
Кд = [H+] · [Ind–] / [HІnd] = 1·10-4
Молекулярна форма (HІnd) цього індикатора має червоне забарвлення, а йонна (Ind–) – жовте. Позначимо концентрацію молекулярної форми через Счерв., а йонної – Сжовт. Тоді одержимо:
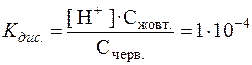
Забарвлення індикатора визначається співвідношенням його молекулярної та йонної форм, яке в свою чергу залежить від концентрації гідроген-іонів. Счерв. / Сжовт. = [H+] / 1·10–4;
Співвідношення Счерв. / Сжовт. при зміні рН також змінюється в широких межах. Однак при візуальному спостереженні зміна забарвлення розчину помітна не при всякій зміні рН. Наприклад, якщо рН=1, тобто [H+] = 1·10–1 моль/дм3 , то можна розрахувати співвідношення двох забарвлених форм індикатора: Счерв. / Сжовт. = [H+] / 10–4 =1· 10–1/1·10–4 = 1000. Тобто, при рН =1 в розчині на 1000 частинок червоного кольору припадає одна частинка жовтого кольору. Око сприймає таке забарвлення як червоне.
При зміні кислотності розчину до рН=2 знаходимо: Счерв./Сжовт.=[H+]/1·10–4 =1·10–2/1·10–4= 100. При такому співвідношенні концентрацій частинок червоного та жовтого кольору (100:1) забарвлення розчину сприймається також як червоне. Тобто, хоч при зміні рН від 1 до 2 співвідношення двох забарвлених форм також змінилось, однак це практично не вплинуло на забарвлення розчину. При подальшому збільшенні рН спостерігається більш помітна зміна забарвлення індикатора. Так, при рН=3 співвідношення Счерв./Сжовт.=10/1 і колір розчину буде сприйматись як червоний з оранжевим відтінком. При рН= 4 співвідношення Счерв./Сжовт.=1:1 (тобто одна частинка червона і одна частинка жовта), розчин буде мати оранжевий колір. При рН=5 співвідношення Счерв./Сжовт.=1:10. В цей момент на одну червону частинку припадає десять жовтих і око сприймає забарвлення розчину як жовте (з оранжевим відтінком). При подальшому збільшенні рН забарвлення розчину не зміниться – розчин буде жовтим.
Тобто, при поступовій зміні рН розчину забарвлення індикатора змінюється досить різко в деякому інтервалі значень рН розчину. Інтервал, в якому зі зміною рН помітно змінюється колір індикатора, називається інтервалом переходу забарвлення індикатора.В даному випадку інтервал переходу забарвлення дорівнює рН = рК ± 1.
Інтервал переходу забарвлення індикатора не є абсолютно точною характеристикою. Він залежить від інтенсивності забарвлення обох форм індикатора, а також від сприйняття ока до різних кольорів. Однак знання інтервалу переходу необхідно для вибору індикатора при титруванні. Цілком зрозуміло, що в рамках звичайної шкали рН від 0 до14 не можна обмежитись якимось одним індикатором і вважати його кращим. Для різного роду титрувань необхідно мати цілий набір індикаторів. При цьому, індикатори, які змінюють забарвлення в кислому середовищі, іноді називають сильними. Ці індикатори в дуже розведених водних розчинах порівняно сильно дисоціюють і тому забарвлені в колір йонної форми (метилоранж – жовтий).
Індикатори з інтервалом переходу забарвлення при рН >7 називають слабкими.
Деякі індикатори є двохосновними кислотами і відповідно мають два інтервала переходу при різних значеннях рН (тимоловий синій, фенолфталеїн).
Фенолфталеїн має властивості багатоосновної кислоти і тому в концентрованих розчинах лугів знебарвлюється.
Таблиця 3
Дата добавления: 2020-10-14; просмотров: 1097;











