Иммобилизация как путь повышения эффективности и стабильности
Высокая лабильность Ф к различным факторам окружающей среды (значению рН, температуре), быстрая инактивация в организме и выделение из организма, наличие антигенных свойств чужеродных организму белков - в значительной мере могут быть устранены при использовании Ф в иммобилизованном виде.
Иммобилизация Ф - это повышение их стабильности. Существует несколько общепринятых методов иммобилизации Ф, которую проводят в строго асептических условиях, но ни один из существующих методов иммобилизации биологически активных молекул, таких, как Ф, антитела, антигены, не является универсальным.
Самый простой способ иммобилизации Ф — физический метод (адсорбция на нерастворимом носителе). В основе метода лежат действия электростатических сил и сил поверхностного натяжения. Процедуpa иммобилизации состоит в смешивании при соответствующих условиях Ф и носителя, инкубации и отделении нерастворимого компонента смеси от растворимого центрифугированием или фильтрованием. Недостаток этого метода — непрочная связь Ф с носителем. Например, адсорбция Ф на носителе ДЭАЭ — сефадекс (диэтиламиноэтил) осуществляется за счёт множественных солевых связей. На такого рода связи влияют даже незначительные изменения рН, ионной силы, температуры и природы растворителя, что может приводить к десорбции фермента с носителя, десорбцию Ф может вызвать даже субстрат. Кроме солевых связей во взаимодействии Ф с носителем могут участвовать и другие слабые силы, например, водородные или ван-дер-ваальсовые.
Материалы, используемые для адсорбции Ф: алюминия оксид, бентонит, кальция карбонат, гель кальция фосфата, активированный уголь, целлюлоза, глина белая, коллаген, ионно-обменные смолы, фенольные полимеры, силикагель.
Адсорбция - мягкий метод иммобилизации, который, как правило, слабо влияет на каталитическую активность Ф.
Иммобилизация Ф с помощью ковалентного связывания считается мягким методом. Способ основан на образовании химической связи между молекулами Ф и носителя. При этом важно, чтобы аминокислоты, необходимые для проявления каталитической активности Ф, не участвовали в ковалентном связывании с носителем. Способ ковалентной иммобилизаций может приводить к снижению ферментативной активности. Инактивацию можно предотвратить, проводя иммобилизацию в присутствии субстрата, защищающего активный центр. Типичные во-донерастворимые носители, используемые для ковалентной иммобилизации - агароза (сефароза), целлюлоза, декстран (сефадекс), сополимеры полиакриламида, полиаминостирол.
Для ковалентного присоединения требуется предварительная активация носителя. Активированный носитель может реагировать с опре-
ч.
делёнными группами Ф: а- и е-аминогруппами остатков лизина, функциональными группами остатков тирозина, гистидина, аргинина, цис-теина. Например, носитель сефароза активирована бромцианом, что основано на реакции между бромцианом и гидроксильными группами сефарозы; образующиеся при этом имидокарбонатные группы могут реагировать со свободными аминогруппами Ф.
Для определения количества Ф, иммобилизованного на носителе, измеряют ферментативную активность исходного раствора, который инкубирован с носителем, и активность, остающуюся в растворе после завершения процесса иммобилизации. Разность между этими активностями соответствует теоретическому или максимальному количеству иммобилизованного Ф.
Иммобилизация Ф металлохелатным методом. Для этой цели используют свойства переходных металлов образовывать комплексы. В качестве переходных металлов используют титана хлорид чистый или в кислом растворе, гидроксиды титана, циркония, хрома (их оксиды не токсичны), железа, ванадия, олова. В качестве носителей - производные целлюлозы и силикагели (с соответствующим размером пор), глутаро-вый альдегид. Гелеобразные гидратированные оксиды металлов образуют с Ф нерастворимые комплексы, обладающие хорошей ферментативной активностью. На полисахаридных носителях, именно целлюлозе, получают препараты иммобилизованных Ф с наиболее высокой активностью.
Например, хелатный комплекс титана хлорида и целлюлозы (D-глюкопиранозы); гидроксильные группы в положении 6 D-глюкопира-нозы, взаимодействуя с ионами титана, образуют полимерный хелат. В нейтральном водном растворе между полимером, активированным титана хлоридом, и Ф образуется ковалентная связь; далее смесь должна быть полностью высушена. Температура высушивания избирательна, но она не должна превышать 50 °С; обычно активирование носителя проводят под вакуумом. Связывание Ф с титановыми комплексами полимеров происходит в молекуле Ф по свободным карбоксильным группам кислых аминокислот, фенольным гидроксилам остатков тирозина, спиртовым гидроксильным группам остатков серина и треонина, свободным сульфгидрильным группам остатков цистеина, е-аминогруппам остатков лизина.
Иммобилизация клеток и Ф с включением в гель относится к механическим методам. Гель, в который включают клетки, как правило, состоит из сферических частиц. Включение живых клеток и Ф требует мягких условий иммобилизации, носитель должен представлять систему открытых пор с хорошими условиями для газообмена.
Включение клеток в полиакриламидный гель. Полиакриламид (ПАА) - носитель, чаще других используемый для включения Ф, так как он не обладает ионно-обменными свойствами, поэтому при иммобилизации рН-профиль активности Ф практически не меняется. Для удерживания включённых белков с носителем требуется высокая степень сшивки носителя, т.е. полная полимеризация. Важным фактором при этом является удаление кислорода из раствора.
Включение клеток в гель кальция алъгината. Альгинат — основной структурный полисахарид бурых морских водорослей. Моновалентные катионы полисахарида даже в низких концентрациях образуют вязкий раствор в присутствии двухвалентных катионов, особенно кальция, что способствовало широкому применению альгината для иммобилизации живых клеток. Ионы кальция можно заменить другими двухвалентными катионами, например бария. Важно отсутствие в системе хелати-рующих агентов, таких, как фосфаты и цитраты, разрушающие структуру геля, связывая кальций.
Включение клеток в гели каррагенина. Каррагенины - гетероциклические полисахариды, содержащие эфиры a-D-галактопиранозил серной кислоты. В водном растворе каррагенин (гель) при добавлении ионов кальция образует нерастворимую фракцию.
Включение клеток в гели агара. Препараты клеток, включенных в агар, как и в каррагенин, получают в виде сферических частиц. Иммобилизацию проводят в растворе, нагретом до температуры, при которой агар остаётся жидким. Затем добавляют клетки и смесь охлаждают до образования геля. Как и в случае с каррагенином, клетки должны быть устойчивы к нагреванию при 40 °С. Иммобилизацию проводят в реакторе при непрерывном режиме с перемешиванием или в реакторах, работающих в режиме псевдоожижения. В процессе полимеризации геля молекулы Ф связываются на небольших расстояниях и Ф оказывается заключённым внутри ячеек геля. Размеры пор геля должны быть меньше размера молекул Ф, но они не должны препятствовать доступу субстрата к Ф.
Иммобилизация Ф микрокапсулированием. Основное при этом виде иммобилизации - удержание раствора, окружающего Ф. Иммобилизуется целиком исходный раствор, содержащий Ф, а не отдельные молекулы Ф. Преимущество микрокапсулирования — большая площадь поверхности, приходящаяся на единицу активности иммобилизованного Ф, позволяющая использовать высокие концентрации Ф в исходном растворе и достигать большей эффективности действия иммобилизованного Ф. Размер микрокапсул составляет десятки или сотни микрон.
Для предотвращения Ф от инактивации с органическими растворителями и мономерами перед микрокапсулированием Ф смешивают с полимерами, способствующими сохранению его активности — бычьим сывороточным альбумином, гемоглобином, ПВП, ПВС, ПЭГ в концен-
трации 1%. Гидрофобные участки полимеров экранируют молекулу Ф, защищая её в процессе микрокапсулирования.
Для образования микросфер в органическом растворителе используют эмульгатор (span-85 в концентрации 0,1%) для покрытия поверхностей капелек водной фазы, что предохраняет Ф от непосредственного контакта с органическим растворителем.
Физические и химические свойства микрокапсулированных Ф зависят от природы полимера, из которого формируется микрокапсула. Полимер должен обладать когезионными свойствами, обеспечивающими образование непрерывной плёнки, быть проницаем для субстрата, инертным по отношению к реакционной смеси. Для получения микрокапсул используют природные и синтетические полимеры - карбокси-метилцеллюлозу, ацетатфталат целлюлозу, нитрат целлюлозы, желатин, эпоксидные смолы, полиуретаны, стирол, полиамиды.
Для микрокапсулирования ферментных систем чаще всего используют коацервацию. Полимерами для коацервации являются - ацетат и нитрат целлюлозы, бутадиеновый каучук.
Микрокапсулирование включает следующие стадии:
1) Растворение Ф в буферном растворе, содержащем для защиты Ф от денатурации другие белки, например альбумин.
2) Приготовление органической фазы, содержащей эмульгирующий агент, например, span-85. Органическая фаза не должна смешиваться с водой; обычно это эфир, циклогексан, толуол.
3) Внесение водного раствора Ф в органическую фазу, перемешивание в течение заданного времени с определённой скоростью; от скорости перемешивания зависит размер микрокапсул.
4) Добавление к двухфазной смеси второго органического раствора, содержащего полимер и органический растворитель (перечисленные на второй стадии). При добавлении второго органического раствора происходит образование мелкого коллоида, обусловленное разбавлением органического растворителя.
5) Не прекращая перемешивания в условиях вакуума (до 25 мм рт. ст.), отгоняют органический растворитель, при этом происходит дальнейшее осаждение водных микросфер с плотной мембраной. Толщина мембраны зависит от количества полимера, добавленного к органической фазе и времени преципитации.
6) Выделение микрокапсул из органической фазы центрифугированием и промывка буферным раствором, содержащим твин-20.
Включение Ф в липосомы. Известно, что липосомы — бислойные сферические образования с водной фазой внутри или полислойные образования, состоящие из нескольких концентрических бислоев с внутренней полостью и размером до 10 нм.
Для получения липосом Ф или другие БАВ в водных растворах подвергают УЗ-обработке в присутствии положительно или отрицательно заряженных фосфолипидов.
В зависимости от физических параметров фосфолипидов (заряда, жидкости, размера) липосомы проникают в клетку эндоцитозом или за счет слияния с природными мембранами. При эндоцитозе фосфолипид-ная оболочка липосом внутри клеток разрушается фосфолипазами и Ф высвобождаются в цитоплазму; при слиянии с клеточной мембраной фосфолипидный комплекс липосом входит в состав клеточных мембран, активная субстанция поступает в цитоплазму.
Направленность действия липосом может быть изменена за счет состава компонентов, образующих мембрану, сродство липосом к клеткам-мишеням усилено специфическими факторами (антителами и др.).
Таблетки и гранулы ферментных препаратов (трипсина, лизоцима, щелочной фосфотазы, каталазы и др.) получают в смеси с биосовместимыми полимерами (ПАВ, ПВП, ПВС и др.). Имплантированный в очаг поражения или поблизости от него Ф, находящийся в полимере, практически полностью защищен от воздействия агрессивной физиологической среды. Из полимера Ф выходит в нативном состоянии, скорость его последующей инактивации и выведения (как и вызываемые им токсические, аллергические и иммунные реакции) аналогична нативному Ф, применяемому традиционным способом.
Ферментсодержащие препараты с помощью катетеризации вводят непосредственно в мышечную ткань или в капиллярную сеть поражённого органа, иммобилизованные Ф поддерживают там высокую локальную концентрацию.
Иммобилизованные на водорастворимой полисахаридной матрице тромболитические Ф (стрептодеказа, стрептокиназа, целиаза), депонируемые в место расположения тромба методом катетеризации, эффективны в меньшей дозе.
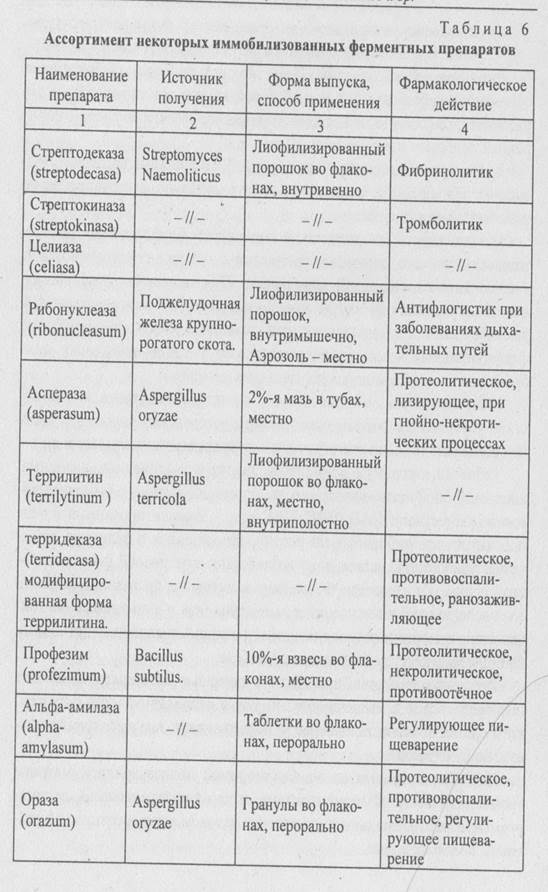

8.2.3. Иммобилизованные растительные клетки
Известно широкое использование иммобилизованных Ф в качестве стабильных биокатализаторов. Иммобилизованные клетки микроорганизмов способны относительно долго осуществлять характерные для них биохимические процессы. Иммобилизованные клетки бактерий, грибов способны синтезировать соответствующие антибиотики; главное - подбор метода иммобилизации клеток - продуцентов антибиотиков, позволяющего сохранить способность клеток синтезировать большое количество того или иного антибиотика длительное время.
Растительные клетки весьма чувствительны к изменениям окружающей среды, и для их иммобилизации могут быть использованы только наиболее мягкие методы, например включение в гель кальция альгината. С помощью иммобилизации растительных клеток частично или полностью удаётся решить проблемы, связанные с использованием культур растительных тканей для получения сложных органических соединений. Например, иммобилизованные клетки Digitalis lanata способны осуществлять 1-2-Р-гидроксилирование производного дигоксина с образованием дигитоксина - единственного препарата наперстянки, который используется во всём мире.
Разработана технология получения биологически активных веществ из биомассы растительных клеток, культивируемых в ферментерах различной вместимости суспензионным способом. Созданы коммерческие препараты (женьшень, шиконин и др.) Получен патент на штамм женьшеня ДАН-25.
Иммобилизованные клетки используют при трансформации стероидных соединений, так как некоторые стероидтрансформирующие Ф, особенно гидроксилазы и дегидрогеназы, - весьма лабильные белки. В качестве носителей используют ПАА, ПВС, каррагенины, агар, кальция альгинат.
Тест-контроль к главе 8 Выберите правильные ответы:
, 1. Изоэлектрическая точка - это:
А - рН среды, при котором молекула белка не несёт заряда;
Б - рН среды, при котором молекула белка несёт максимальный заряд;
В - рН среды, при котором фермент имеет максимальную активность;
Г - рН среды, при котором фермент теряет активность.
2. Пептидная связь играет ключевую роль в образовании:
А - первичной структуры белковой молекулы;
Б - вторичной структуры белковой молекулы;
В - третичной структуры белковой молекулы;
Г - четвертичной структуры белковой молекулы.
3. Витамин РР входит в небелковую часть ферментов:
А - НАД зависимых дегидрогеназ;
Б - ФАД зависимых дегидрогеназ;
В - переаминирования аминокислот;
Г - декарбоксилаз.
4.Витамин В2 входит в небелковую часть ферментов:
А - НАД зависимых дегидрогеназ;
Б - ФАД зависимых дегидрогеназ;
В - переаминирования аминокислот;
Г - декарбоксилаз.
5. Преимущество метода микробиологического синтеза ферментов перед получением их из животного сырья:
А - доступность сырья;
Б - безопасность производства;
В - получение рацемата;
Г-можно использовать более доступные методы стандартизации.
6. В состав препаратов, применяемых при гнойно-некротических процессах, входят ферменты:
А - аминолитические;
Б - протеолитические;
В - липазы;
Г - дегидрогеназы.
7. Для производства ферментов в настоящее время используется методпромышленного культивирования микроорганизмов:
А - поверхностное культивирование;
Б - глубинное культивирование.
8. Сорбент для гель-фильтрационной очистки белков и ферментов:
А - алюминия окись;
Б - молселект;
В - ионно-обменные смолы;
Г - уголь активированный.
9. Механизм гель-фильтрационного метода очистки белков и ферментов основан на:
А - сорбционно-десорбционных процессах на активных центрах;
Б - различной растворимости веществ в фазах сорбента;
В - ионном обмене;
Г - «молекулярном ситовании».
10.В процессе выделения из культуральной среды ферментов и их очистки НЕ используется:
А - экстракция;
Б - сорбционные процессы;
В - осаждение (высаливание);
Г - перегонка с водяным паром.
11.Выражение, соответствующее понятию «иммобилизованные ферменты»:
А - ферменты, сохраняющие значительную активность в широком диапазоне рН;
Б - ферменты, сохраняющие свою структуру и активность длительное время.
12. Химический метод иммобилизации ферментов:
А - образование ковалентных связей между носителем и ферментом;
Б - включение фермента в микрокапсулы;
В - включение фермента в полимерные гели;
Г — включение фермента в волокна полимера.
13. Связь, не участвующая в образовании а-спирали из первичной структуры белка:
А — пептидная связь;
Б - водородная связь;
В - ионные взаимодействия;
Г - ван-дер-ваальсовы взаимодействия.
14. Химическая природа кофермента:
А - ионы металлов;
Б - витамины;
В - нуклеотиды;
Г - олигосахариды.
15. Величина аминокислотных остатков, образующих один виток а-спирали, составляет:
А - 0,54 аминокислоты;
Б - 5,4 аминокислоты;
В - 0,36 аминокислоты;
Г - 3,6 аминокислоты.
16. Какая характеристика не относится к растворам белков:
А - растворы высокомолекулярных соединений;
Б - конус Тиндаля;
В - светорассеяние;
Г - светопреломление.
17. Гель-фильтрация - это метод:
А - высаливания белков;
Б - отделения растворителя от раствора;
В - определения заряда белка;
Г - фракционирования белков.
18.Протеомика характеризует состояние микробного патогена:
А - по ферментативной активности;
Б - по скорости роста;
В - по экспрессии отдельных белков;
Г - по нахождению на конкретной стадии ростового цикла.
19.Гены house keeping у патогенного микроорганизма экспрессируются:
А - в инфицированном организме хозяина;
Б - всегда;
В — только на искусственных питательных средах;
Г - под влиянием индукторов.
20.Для получения протопластов из клеток грибов используется:
А - лизоцим;
Б - трипсин;
В - «улиточный фермент»;
Г - пепсин.
21.Для получения протопластов из бактериальных клеток используется:
А - лизоцим;
Б - «улиточный фермент»;
В - трипсин;
Г - пепсин.
22.Выделение и очистка продуктов биосинтеза и оргсинтеза имеют принципиальные отличия на стадиях процесса:
А - всех;
Б - конечных;
В - первых;
Г - принципиальных различий нет.
23.Основное преимущество ферментативной биоконверсии стероидов перед химической трансформацией состоит:
А - в доступности реагентов;
Б - в избирательности воздействия на определённые функциональные группы стероида;
В - в сокращении времени процесса;
Г - в получении принципиально новых соединений.
24. Фермент лигаза, используемый в генетической инженерии:
А - скрепляет вектор с оболочкой клетки хозяина;
Б - катализирует включение вектора в хромосому клеток хозяина;
В - катализирует ковалентное связывание углеводно-фосфорной
цепи ДНК-гена с ДНК-вектора;
Г — катализирует замыкание пептидных мостиков в пептидогли-
кане клеточной стенки.
25.Иммобилизация индивидуальных ферментов ограничивается:
А - наличием у фермента кофермента;
Б — наличием у фермента субъединиц;-
В - принадлежностью фермента к гидролазам;
Г - каталитической активностью фермента.
26.Иммобилизация целых клеток продуцентов лекарственных веществ НЕрациональна в случае:
А-высокой лабильности целевого продукта (лекарственного вещества);
Б - использования целевого продукта в инъекционной форме;
В - внутриклеточной локализации целевого продукта;
Г - высокой гидрофильное™ целевого продукта.
27. Целями иммобилизации ферментов в биотехнологическом производстве являются:
А - повышение удельной активности;
Б - повышение стабильности;
В - расширение субстратного спектра;
Г - многократное использвоание.
28.Целевой белковый продукт локализован внутри иммобилизованной клетки. Добиться его выделения, не нарушая системы, можно:
А - усилив системы активного выброса;
Б - ослабив барьерные функции мембраны;
В - присоединив к белку лидерную последовательность от
внешнего белка;
Г - повысив скорость синтеза белка.
29.Экономическое преимущество биотехнологического производства, основанного на иммобилизованных биообъектах, перед традиционным обусловлено:
А — меньшими затратами труда;
Б - более дешёвым сырьём;
В - многократным использованием биообъекта;
Г - ускорением производственного процесса.
30.Термин «мультферментный комплекс» означает:
А — комплекс ферментных белков, выделяемый из клетки путём
экстракции и осаждения;
Б - комплекс ферментных клеточных мембран;
В - комплекс ферментов, катализирующих синтез первичного
или вторичного метаболита;
Г - комплекс экзо- и энопротеаз.
Дата добавления: 2016-07-22; просмотров: 4035;











