Промышленное производство ферментов, получаемых биотехнологическими методами
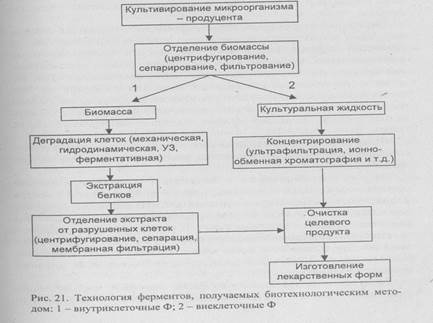
Схема производства Ф микробиологического происхождения представлена на рис. 21.
8.1.1. Культивирование продуцентов ферментов
Интенсивность биосинтеза любого фермента микроорганизмом, его продуктивность обусловлена генетическими свойствами продуцента. Функционирование биосинтетической системы регулируется составом питательной среды и динамикой изменения отдельных ее компонентов во время роста микроорганизмов. Культивирование микроорганизмов -продуцентов ферментов целесообразно в средах строго детерминированного состава, обеспечивающих направленный биосинтез нужного Ф.
Синтез многих Ф репрессируется легкоусвояемыми источниками углерода (глюкозой, фруктозой, маннозой и др.); этот эффект носит название катаболитной репрессии (иногда глюкозным эффектом). Катабо-литной репрессии подвержен биосинтез таких Ф, как а-амилаза, целлю-лаза, глюкоамилаза, инвертаза, трансэлиминаза полигалактуроновой кислоты.
Ферменты, катализирующие превращение азотсодержащих субстратов, также регулируются по механизму катаболитной репрессии; их биосинтез репрессируется ионами аммония или быстроусвояемыми аминокислотами. Аминокислоты в анаэробных условиях культивирования инициируют биосинтез соответствующих декарбоксилаз. При наличии в среде большой концентрации мочевины стимулируется биосинтез уреазы. Введение в среду культивирования аргинина индуцирует биосинтез аргиназы. Источниками органического азота могут служить пептон, триптон, дрожжевой экстракт, гидролизат казеина или любая их смесь.
Наличие в среде культивирования различных биополимеров обусловливает одновременное накопление комплекса протеаз, амилаз, нук-леаз, липаз.
На рост микроорганизмов и биосинтез Ф существенное влияние оказывают ионы кальция, марганца, цинка и др. Ионы железа и магния активируют и стабилизируют протеолитические ферменты. Присутствие ионов железа и меди в среде культивирования существенно для биосинтеза железо- и медьсодержащих Ф, участвующих, как правило, в окислительно-восстановительных реакциях (утилизации и превращения энергии). Отсутствие таких ионов может негативно отразиться на скорости многих метаболических процессов и на биосинтезе Ф, катализирующих эти процессы.
Продуценты Ф, относящиеся к строгим анаэробам, требуют полностью безкислородных условий культивирования и очень богатых, полноценных сред. Процесс культивирования в этом случае можно проводить в более простых ферментерах, так как не нужна аэрация и перемешивание.
Оптимизация питательных сред и условий культивирования для обеспечения направленного биосинтеза продуцентом целевого продукта является важным этапом разработки биотехнологического процесса получения высокоочищенных Ф. Преимущественный биосинтез культурой нужного продукта с минимальным содержанием посторонних белков позволяет в дальнейшем существенно упростить выделение и очистку Ф.
8.1.2. Переработка культуральной жидкости
Большинство Ф промышленного производства относится к внеклеточным, поэтому они находятся в культуральной жидкости. При выделении внутриклеточных Ф (изоферментов) основной задачей является сбор клеток, содержащих Ф.
Глубинная культура представляет собой суспензию, содержащую остатки питательных веществ, продукты метаболизма (в том числе внеклеточные Ф), взвешенные клетки продуцента. В период культивирования обычно происходит ограниченный лизис микробных клеток и в суспензии появляется неконтролируемое количество внутриклеточных метаболитов. Из этой достаточно сложной и многокомпонентной смеси приходится выделять и очищать один Ф.
Технологический процесс начинают с разделения растворимых и нерастворимых веществ, концентрирования и фракционирования, заканчивают разнообразными способами хроматографической очистки.
Фильтрация жидкости, содержащей мелкодисперсный клеточный материал, частично разрушенные клетки и внутриклеточные полимеры, сопряжена с определенными трудностями. Фильтруемый раствор вязок, склонен к гелеобразованию, осадок сжимается и закупоривает поры фильтра. Для избежания этого применяют крупнопористые фильтрующие материалы - диатомиты, кизельгур, бентонит, фильтроперлит и др.: они задерживают очень мелкие частицы, образуются несжимаемые слои фильтрующего материала и биомассы, которые не изменяют фильтрующих свойств и не забивают фильтры. На фильтрующем материале может происходить сорбция или денатурация некоторых белков, в результате значительно снижается выход Ф. Обработка фильтроперлита раствором ЭДТА уменьшает потери на 2-6%.
Сепарацию клеточной массы и сопутствующих конгломератов осуществляют с помощью центрифуг (фирмы «Beckman», США, MSE, Англия, «Hitadi», Япония).
Дезинтеграция биомассы. Основное количество Ф обычно находится внутри клеток, где он образует комплексы с другими биополимерами. Клеточные структуры могут быть разрушены в результате прямого механического воздействия (баллистическими, УЗ-, экструзионными, ферментативными методами - см. гл. 5.7). После дезинтеграции биомассы продуцента фермента получается вязкая, опалесцирующая суспензия, содержащая фрагменты клеточных стенок, субклеточных структур и продукты их деградации, а также самые разнообразные высоко- и низкомолекулярные органические вещества. Ферменты находятся в растворенном состоянии, поэтому на одной из первой стадий обработки клеточного гомогената должны быть удалены нерастворимые частицы. Для этого применяют скоростное центрифугирование. Образуется прозрачный клеточный экстракт, содержащий только растворенные биополимеры и низкомолекулярные компоненты. Среди нежелательных процессов, которые могут происходить в таком растворе - протеолиз собственными клеточными протеазами, что влечет потерю каталитической способности, изменение специфичности или стабильности выделяемого Ф. Этот процесс может протекать несмотря на поддержание низкой температуры, особенно при очистке Ф, так как после удаления сопутствующих белков Ф становится единственным субстратом протеазы.
Инактивацию протеаз осуществляют обработкой клеточного экстракта специфическими ингибиторами-комплексонами (ЭДТА, о-фенантролин, оксихинолин), солями ртути или серебра. Протеазы из клеточных экстрактов могут быть удалены сорбцией на аффинных сорбентах. Если протеазы термолабильны, а выделяемый Ф термостабилен, их можно денатурировать нагреванием клеточных экстрактов. Денатурацию нуклеиновых кислот в процессе очистки Ф обусловливает низкая ионная сила или основность среды. Можно использовать специальные осадители, образующие с нуклеиновыми кислотами нерастворимые комплексы. С этой целью применяют бромистый цетилтриметиламмо-ний, стрептомицинсульфат, протаминосульфат, полиэтиленимин. Полнота удаления нуклеиновых кислот зависит от рН и ионной силы раствора, концентрации осадителя и белка. Чтобы белки остались в растворенном состоянии, повышают ионную силу растворов. По эффективности осаждающего действия на нуклеиновые кислоты в экстрактах Е. coli осадители располагаются в следующем порядке: полилизин > полиэтиленимин > бромистый цетиолтриметиламмоний > стрептомицинсуль-фат > протаминсульфат > магния хлорид.
Другой способ удаления нуклеиновых кислот из клеточных экстрактов - их гидролиз под действием нуклеаз; для этого применяют панкреатические ДНК-азу и РНК-азу.
Значительную часть биополимеров можно удалить термообработкой клеточных растворов, если Ф термостабилен. Далее проводят хро-матографическую очистку, в том числе аффинную.
В качестве сорбентов применяют различные гели — фосфатов кальция, гидроксида алюминия, реже - древесный уголь или гель гидрооксида цинка. Сорбцию на гелях проводят в слабокислых растворах (рН 5,0-6,0); важны оптимальные соотношения между количеством геля и белкового раствора. Гель, содержащий сорбированный Ф, отделяют центрифугированием.
Для ультрафильтрации используют мембранные фильтры, селективность и скорость работы которых зависят от давления, гидродинамических условий, температуры, состава фракционируемой смеси и ее концентрации.
Для фракционирования белковых растворов используют нейтральные соли. Известно, что растворимость белков зависит от величины молекул белка, степени их гидратации и ионной силы солевых растворов. Растворяясь, соль связывает воду и, таким образом, изменяет степень гидратации молекул белка, что приводит к их агрегации и образованию осадка. С этой целью применяют аммония сульфат, который обладает стабилизирующим эффектом по отношению ко многим Ф. Обычно выход Ф при фракционировании аммония сульфатом достигает 100%.
Фракционирование белков растворителями. При смешивании органических растворителей с водой изменяется ее диэлектрическая константа и соответственно степень гидратации молекул, вплоть до замены молекул воды молекулами органического растворителя. Все это ускоряет образование нерастворимых агрегатов белковых молекул. Обычно для фракционирования растворов Ф применяют этанол и ацетон. При повышенной температуре (более 4 °С) в водно-органических смесях Ф денатурируют, поэтому работы с органическими растворителями проводят при низких температурах. Органический растворитель охлаждают до (-30) - (-40 °С) сухим льдом или жидким азотом; температура смеси поддерживается при этом на уровне от -10 до -20 °С. Осадок центрифугируют, затем растворяют в небольшом объеме буферного раствора,
удаляя следы органических растворителей диализом или ультрафильтрацией через гель.
Для хроматографического фракционирования применяют ионно-обменную, аффинную хроматографию и гель-фильтрацию. Наиболее эффективная очистка Ф достигается ионно-обменной хроматографией с использованием сорбентов на основе сополимеров метакриловой кислоты и различных гидрофобных мономеров. В препаративной энзимоло-гии применяют иониты на основе натуральных или полусинтетических полисахаридных матриц (ионно-обменные целлюлозы). Среди многих производных целлюлозы чаще используют ДЭАЭ-, ТЭАЭ-, КМ- и фос-фоцеллюлозы (первые два - аниониты, последние - катиониты). Предпочтительна гранулированная целлюлоза, гидродинамические свойства которой позволяют проводить хроматографический процесс с большой скоростью.
После элюирования из колонки функционально активных белков сорбент подлежит регенерации. Для удаления неактивных белков, пигментов и др. сорбированных соединений колонку промывают щелочами, водой, кислотами и вновь водой. Иногда для полного удаления пигментов используют органические растворители или детергенты. Процесс регенерации колонки завершается обработкой стандартным буферным раствором.
Фракционирование смесей Ф, имеющих различный размер молекул, проводят гель-фильтрацией на разных типах сефадексов - модифицированных производных линейного полисахарида полидекстрана. Для фракционирования крупномолекулярных смесей применяют поперечно-сшитые акриламиды под названием ультрагелей (фирма LKB, Швеция) и агарозу в поперечно-сшитом состоянии (сефарозы CL 2В, 4В и 6В). В поперечно-сшитых агарозах хроматографический процесс можно осуществить в широком интервале рН и температуры, использовать буферные растворы, содержащие органические растворители, соли. Аналогичными свойствами обладают декстраны, поперечно-сшитые акрила-мидом сефакрилы: на них можно фракционировать смеси белков с м.м. от 105 до 107.
Наряду с натуральными и полусинтетическими полисахаридными матрицами для гель-фильтрации используют синтетические поликри-ламидные гели (биогель Р, акрилекс фирм «Bio Rad Laboratories», США и «Reanal», Венгрия). Большое количество аминогрупп в их структуре придает полимеру гидрофобные свойства, хорошую набухаемость в воде с образованим пористой структуры геля. К синтетическим гелям относят также оксиакрилметакрилатные гели-сфероны (фирма «Lachema»,Чехия).
Для гель-хроматографии, в отличие от других методов хроматогра-фического разделения белков, не требуется обессоливать пробу, корректировать рН, не нужны специальные элюирующие буферы. Смесь белков, продвигаясь по сорбенту, освобождается от солей и распределяется в порядке уменьшения м.м. Белки и другие компоненты смеси с сорбентом не взаимодействуют. Из колонки вначале выходят самые крупные молекулы, затем — меньшими м.м. и, наконец, соли.
В большинстве случаев после того, как из сорбента вышли белки и все низкомолекулярные компоненты, колонка пригодна для применения в следующем хроматографическом цикле.
Аффинная хроматография характеризуется высокими выходом и степенью очистки выделяемого белка. Основа этого биоспецифического метода состоит в том, что в многокомпонентной смеси между одним или несколькими белками-ферментами и полимерными сорбентами образуется стабильная связь, в результате чего эти белки из раствора переходят на нерастворимый сорбент. Чем меньше белков связывает сорбент, тем выше его селективность (идеальная селективность - связывание одного Ф). Центром связывания служат субстраты, их аналоги, обратимые ингибиторы, коферменты, антитела и другие вещества, называемые лигандами, присоединенные к матрицам. Лиганды специфически взаимодействуют с активными центрами выделяемого Ф. В качестве лигандов используют синтетические аналоги субстратов или кофер-
ментов.
Матрицей сорбента, к которой присоединен лиганд, может быть
любой полимер, обладающий:
крупнопористой гелевой структурой, позволяющей крупным молекулам Ф проникать внутрь структуры и взаимодействовать с центрами связывания;
гидрофильностью структуры, обеспечивающей взаимодействие с водой и отсутствие неспецифического связывания белков по гидрофобным центрам;
отсутствием в структуре заряженных групп, исключающих образование неспецифичных электростатических связей; способностью полимера легко активироваться определенными химическими агентами, позволяющими за счет несложных процессов присоединять большое количество лиганда;
достаточной химической, механической, микробиологической стойкостью, обеспечивающей стабильность во время работы сорбентов.
Указанным требованиям наиболее полно отвечают различным образом модифицированные агарозы; недостаток агароз - нестойкость к воздействию микроорганизмов, малая механическая прочность, высокая стоимость.
Строгая специфичность аффинного сорбента к выделяемому Ф значительно улучшает сам хроматографический процесс, состоящий из последовательно сменяющихся этапов сорбции, удаления несорбиро-ванных белков и элюирования сорбированного Ф. Условия сорбции подбираются таким образом, чтобы выделяемый Ф сорбировался наиболее полно, а сопутствующие белки не задерживались. Это зависит от рН, ионной силы, природы буферных растворов, температуры. После отмывки сорбента от несорбированных белков резко изменяется один или нескольких из указанных параметров, в результате разрушается комплекс фермента с сорбентом и Ф высвобождается. Элюирование Ф проводят, добавляя в элюент специфически взаимодействующие с ферментом вещества - субстраты, коферменты, растворимые ингибиторы. Как правило, это повышает эффективность очистки, так как специфические агенты не разрушают неспецифические комплексы между сорбентом и сопутствующими белками.
Дата добавления: 2016-07-22; просмотров: 4585;











