Реакционно-ректификационные процессы
Рассмотрим один из многочисленных примеров использования реакционно-ректификационных процессов в производстве основного органического синтеза.
В процессе гидролиза этилсульфатов с целью получения этилового спирта путем сернокислотной гидратации этилена, описанной ранее, имеется побочная реакция образования диэтилового эфира.
На первой стадии гидролиза она подавляется достаточным разбавлением смеси водой, а на второй стадии подавить указанную реакцию удается за счет совмещения гидролиза этилсульфатов с разделением реакционной смеси при ректификации. Именно этот прием позволяет значительно снизить концентрацию этанола в реакционной зоне и тем самым практически исключить побочный процесс.
Известно, что при производстве ценного продукта – поливинилового спирта из поливинилацетата образуется значительное количество метилацетата. Однако несмотря на ценные качества как растворителя, последний не находит широкого применения ввиду высокой токсичности. Вместо него предпочитают использовать менее токсичные растворители, например бутилацетат, который предлагается получать переэтерификацией метилацетата бутанолом:

Процесс осуществляется в непрерывном режиме в реакционно-ректификационном аппарате с использованием в качестве катализатора сильнокислотной катионнообменной смолы.
При условиях осуществления процесса помимо основной может протекать и побочная реакция образования дибутилового эфира:
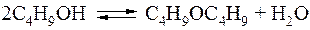
Экспериментальные исследования показали, что в зависимости от способа организации процесса дибутиловый эфир либо не образуется вовсе, либо выход его доходит до 15%. Выяснилось, что помимо концентрационного фактора в зоне расположения катализатора решающее значение имеют температурные условия.
Однако в качестве основного фактора, применяемого для создания благоприятных температурных и концентрационных условий, выступает само разделение. Именно оно обеспечивает особые локальные условия, которые не могут быть получены принципиально без совмещения реакции и разделения. Поэтому-то в совмещенном процессе можно обеспечить такие же или более высокие скорости основной реакции, но в более мягких температурных условиях, а это, как известно, в большинстве случаев приводит к увеличению селективности сложных химических процессов.
Рассмотрим более подробно выбор технологической схемы на примере переэтерификации метилацетата бутанолом.
Бутилацетат – хороший растворитель, в промышленности его получают этерификацией уксусной кислоты бутанолом-1. В нашей стране спрос на этот продукт превышает предложение. Уксусная кислота является также дефицитным продуктом. В частности, она используется в производстве поливинилового спирта:
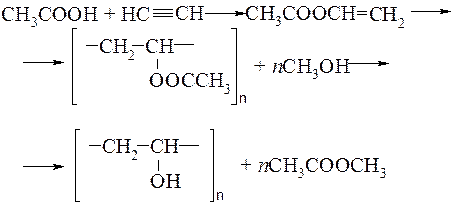
Образовавшийся при получении поливинилового спирта метилацетат подвергается, как правило, кислотному гидролизу:

Получившиеся при гидролизе уксусная кислота и метанол могут быть использованы соответственно на стадиях синтеза винилацетата и получения поливинилового спирта. Однако в этих процессах весьма высокие требования к чистоте реагентов, от которой зависит качество полимеров.
Регенерированные уксусная кислота и метанол не вполне удовлетворяют этим требованиям, так как содержат некоторые нежелательные микропримеси. Поэтому целесообразно включить метилацетат в какой-либо другой синтез, а в указанном вместо регенерированной использовать свежую уксусную кислоту.
Например, при получении бутилацетата метилацетат может оказаться предпочтительным сырьем по сравнению с уксусной кислотой, так как уменьшается скорость коррозии, могут быть созданы при атмосферном давлении более «мягкие» температурные условия проведения процесса, поскольку температура кипения метилацетата вдвое меньше, чем уксусной кислоты. Оба последних преимущества можно удачно использовать, если процесс проводить в присутствии сильнокислотных ионообменников. При этом практически не повышается коррозионная активность и процесс идет при температурах, не снижающих стабильность ионитов.
В соответствии с данными о скорости реакции в качестве условий совмещения выбираем атмосферное давление. Катализатор - катионообменная смола, формованная в виде элементов массобменной насадки. Таким образцом, реакционная зона будет локализована местом расположения в колонне катионообменного катализатора.
В качестве примера для возможных вариантов организации процесса принимаем, что в качестве исходных смесей используются бинарные смеси чистых реагентов метилацетата и бутанола-1. Исследования показали, что максимальной степени превращения отвечают два варианта технологических схем процесса.
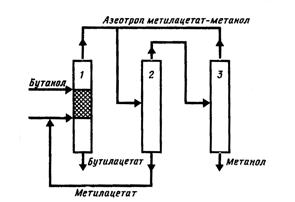
Рис. 5.1 Принципиальная технологическая схема получения бутилацетата
из метилацетата и бутанола:
1 – совмещенный аппарат; 2 – колонна выделения метилацетата;
3 – колонна выделения метанола
В первом варианте (рис. 5.1) конверсия бутанола составит 100%, во втором (рис. 5.2) - 100% достигает степень превращения метилацетата.
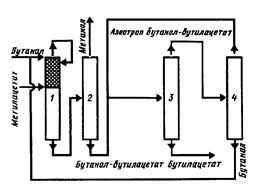
Рис.5.2 Принципиальная технологическая схема получения бутилацетата:
1 – реакционно-ректификационная колонна;
2 – колонна выделения метанола;
3 – колонна выделения бутилацетата; 4 – колонна выделения бутанола
В первом варианте (рис. 5.1) осуществляется разделение азеотропной бинарной смеси метилацетата с метанолом в двухколонной установке (колонны 2 и 3). Колонна 2 работает при повышенном давлении.
Исследования показали, что целесообразно поддерживать давление в колонне 2 0,8105-1,0132 МПа. При этом азеотроп содержит около 45-47 % метилацетата. Температура в кипятильнике колонны не выше 130°С. В этой колонне выделяется чистый метилацетат. Отбор регенерированного метилацетата можно проводить, например, в парах с нижней тарелки колонны, так как в этом потоке будет содержаться минимальное количество катионов металлов. Катионы большинства металлов нежелательны, поскольку быстро снижают активность катализатора.
Колонна, служащая для выделения метанола, работает при атмосферном давлении. Целесообразно (из экономических соображений) организовать работу такой колонны при давлении несколько ниже атмосферного, например 0,0400 МПа. При этом азеотроп содержит уже около 70-72 % метилацетата по сравнению с 62-64 % при атмосферном давлении. Поэтому уменьшается циркуляция между колоннами 2 и 3. Кроме того, несколько возрастает относительная летучесть компонентов. Все это существенно снижает энергетические затраты на разделение.
Работа колонны 3 особенно целесообразна под вакуумом в холодное время года, когда полнота конденсации относительно просто обеспечивается за счет охлаждения промышленной оборотной водой.
По второй технологической схеме (см. рис. 5.2) осуществляется, разделение другой бинарной азеотропной смеси бутилацетат - бутанол в двухколонной установке (колонны 3 и 4). В данном случае наблюдается обратное смещение состава азеотропа: с понижением давления азеотроп обогащается не эфиром, а спиртом.
Содержание бутанола в азеотропе при 0,0220 МПа около 50 %. Температура кипения азеотропа при 0,0220 Мпа - 76,4 °С, соответствующие данные для 0,0067 МПа - 37 % и 50,7 °С.
Необходимо дальнейшее технико-экономическое исследование с целью выбора оптимальных параметров работы и оптимальной схемы. На этой стадии следует уже привлекать сведения о динамике совмещенного процесса. Однако сопоставление совмещенного и несовмещенного процессов можно провести и в рамках статики. Так, проведенные расчеты показали, что в условиях первого варианта, где исходная смесь содержит 25 % бутанола, степень превращения бутанола и метилацетата в состоянии химического равновесия составляет 66 и 22 %, а в предельном стационарном состоянии 100 и 32 % соответственно. Для второго варианта исходная смесь содержит 80,7 % бутанола, конверсии бутанола и метилацетата, отвечающие химическому равновесию, равны 17,2 и 72%соответственно, а в предельном стационарном состоянии те же величины составляют 23,9 и 100 %.
Из приведенных результатов следует очевидное преимущество предлагаемого совмещенного процесса по степени превращения реагентов за одно пропускание смеси через аппарат.
Большое внимание в последнее время уделяется реакционно-мембранным процессам, которые связаны с разделением реакционных смесей в момент их образования через различного рода полупроницаемые мембраны. Одним из примеров организации реакционно-мембранного процесса является технология производства синтетических жидких топлив (СЖТ) из природного газа по Фишеру – Тропшу (технология GTL, gas – to- liquid), разработанная Министерством энергетики США. В отличие, от других аналогичных, эта технология не имеет стадии разделения воздуха для получения кислорода необходимого для кислородной конверсии СН4 с целью получения синтез-газа. Вторая стадия (получение синтез-газа) в этой технологии осуществляется в реакционно-мембранном аппарате, в котором воздух проходит через керамическую мембрану, которая пропускает только кислород в реакционную зону, где на катализаторе образуется синтез-газ.
Таким образом, анализ современных технологий химического производства указывает на то, что принцип совмещения давно и успешно используется в промышленной практике. Применение совмещенных технологий особенно ценно при получении особо чистых веществ, разделении сложных многокомпонентных смесей. Реакционно-массобменные технологии позволяют увеличить степень превращения реагентов, повысить селективность, снизить материало- и энергоемкость производства, то есть являются важным фактором создания малоотходных технологий.
Контрольные вопросы к V разделу
«Совмещенные реакционо- массообменные процессы (СРМП)»
1. Цель и сущность СРМП
2. Классификация СРМП
3. Реакционно-ректификационные процессы. Сущность и примеры применения
4. Реакционно-выпарные процессы
Дата добавления: 2020-10-14; просмотров: 791;











