ХИМИЧЕСКИЕ СВОЙСТВА НАНОМАТЕРИАЛОВ
В учебниках по химии львиная доля рассматриваемых химических превращений составляют реакции в газо- и жидкофазных системах. Твердофазным реакциям, т.е. реакциям с участием твердых реагентов и продуктов отводится очень скромное место, хотя именно эти реакции являются основой процессов получения и эксплуатации большинства современных конструкционных и функциональных материалов, будь то жаропрочные покрытия для космической техники или миниатюрные элементы памяти быстродействующих ПК.
Между реакциями в растворах и газах, с одной стороны, и твердофазными реакциями – с другой, существуют фундаментальные различия.
Отметим некоторые особенности твердотельных реакций.
- Для количественной характеристики твердофазных реакций существет понятие степени превращения. Степень превращения
σ=Ni / Niисх, (13-13)
где Niисх и Ni – число молей ί – го реагента соответственно в исходной системе и к моменту времени τ, прошедшему от начала взаимодействия.
- Сложный характер твердофазного взаимодействия отражены на кинетических кривых σ = f(τ) и dσ/dτ = f(σ)
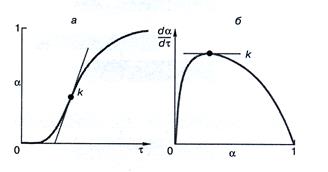
Рис. 198 Кинетические кривые: степень фазового превращения как функция времени (а) и скорость твердофазного превращения как функция степени превращения (б)
Из рис.198а следует, что на начальной стадии реакции ее скорость мала (индукционный период), затем резко возрастает (время роста скорости реакции), проходит через максимум k и далее снижается до нуля. Соответствующая зависимость σ=f(τ) изображается S- образной кривой.
Скорость реакции, достигнув максимума, начинает снижаться, когда растущие зародыши продукта начинают сливаться, образуя сплошной слой (рис.198б)
Использование дисперсных сред показало, что наноматериалы обладают чрезвычайно высокой хим. активностью, которая проявляется в изменении температуры, скорости, теплового эффекта взаимодействия, степени превращения при конкретных условиях реакции, повышенной пирофорности, особых каталитических свойствах.
Наночастицы способны эффективно взаимодействовать со многими инертными веществами, включая инертные газы и благородные металлы. Например, обнаружено, что при дроблении на поверхности нанопорошков происходит необратимая адсорбция инертных газов.
В некотором смысле справедливо утверждение, что для наноматериалов не существует инертной среды. Этому способствует прежде всего сильно развитая поверхность и избыточная энергия поверхностных атомов.
Размерные эффекты в хим. процесса. Размерный эффект в хим. процессах проявляется, прежде всего, в изменении закона реагирования. Скорость хим. реакции для большого количества гетерогенных хим. процессов с участием твердых фаз определяется диффузией в твердом теле. Однако это справедливо, когда радиус реагирующей частицы R существенно больше диффузионного пути (σ), определяемого выражением:
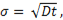 (13-14)
(13-14)
где D - коэффициент диффузии, t – время.
Если σ ≥ D,толимитирующей стадией процесса становится собственно хим. реакция. Следовательно, для гетерогенных реакций существует граничный размер частиц, при котором происходит изменение кинетических закономерностей процесса.
Как показывают расчеты, с уменьшением размера частицы скорость химической реакции экспоненциально возрастает. Данный результат иллюстрирует нижеследующий рисунок (рис. 199), где приведена зависимость максимума скорости реакции W от размера частицы при плотности зародышей карбида железа 0,23.
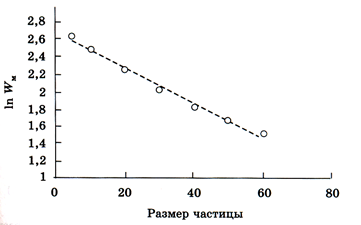
Рис.199 Зависимость максимума скорости реакции от размеров частицы
Одновременно с уменьшением размера частицы время достижения максимальной скорости реакции сокращается.
Еще одним проявлением размерного эффекта в химических процессах является понижение температуры протекания химической реакции. В частности в двухслойных оксидных пленках MgO/Nb2O5 реакции типа
MgO+ Nb2O5 = MgNb2O6
самопроизвольно протекают при температурах на 800-1000К ниже, чем в случае взаимодействия крупнозернистых оксидов.
Также в наноразмерных системах возможны химические превращения, которые невозможны в крупнокристаллических материалах. В частности, обнаружена зависимость реакционной способности алюминиевых кластеров от количества атомов в них. Аналогичная ситуация наблюдается и для реакционной способности других металлов. Так у наночастиц золота размером менее 3-5нм, имеющих, в отличие от ГЦК решетки объемного материала, икосаэдрическую структуру, обнаружена высокая каталитическая активность. Это привело к созданию освежителей воздуха на основе золотых наночастиц.
Самовозгорание и пирофорность наносред. Явления самовозгорания и пирофорности, как правило, очень нежелательны и сильно затрудняют получение и использование наноматериалов.
Самовозгорание - возникновение горения в результате самонагревания твердых материалов, вызванного самоускорением в них изотермических реакций.
Оно происходит из- за того, что тепловыделение в ходе химической реакции больше теплоотвода в окружающую среду. В зависимости от природы самонагревания различают химическое, микробиологическое и тепловое самовозгорание.
Температура самонагревания Тс представляет собой минимальную температуру, при которой обнаруживается тепловыделение. Она определяет начало процесса самовозгорания. По достижении в ходе саморазогрева температуры Тв, называемой температурой самовозгорания , возникает горение материала , которое может осуществляться тлением или пламенным горением.
Пирофорность – явление химического самовозгорания некоторых веществ при контакте их с воздухом в отсутствие нагрева.
Основной особенностью пирофорных веществ является то, что температура их самовозгорания ниже комнатной. К пирофорным относятся такие вещества, как высокодисперсные металлы, карбиды щелочных металлов, белый фосфор, металлоорганические соединения.
Материал бывает пирофорным не всегда. Это зависит от химической природы и массы вещества, дисперсности и формы частиц, от развитости поверхности и наличия в ней защитных пленок. В частности дисперсный порошок железа с насыпной плотностью 1г/см3 заметно склонен к пирофорности. Однако при насыпной плотности 0,5г/см3 железный порошок самовозгорается при температурах выше комнатной. Как правило, при массе нанопорошков порядка 100- 200г наблюдается большой тепловыделение, что приводит к их самовоспламенению на воздухе.
Начало саморазогрева определяется балансом тепловых потоков, т.е. подводом, выделением тепла в самой системе и его отводом. При достаточной массе нанопорошка и скорости нагрева сильный саморазогрев образца приводит к его самовоспламенению.
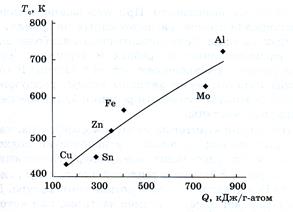
Рис.200 Корреляция между теплотой окисления и температурой саморазогрева при окислении нанопорошков металлов.
В качестве еще одного примера приведем зависимость активности многих частиц от их размера. Активность сравнительно незначительна для стабильных кластеров (типа С60 или Au55 ), но при некоторых размерах кластеров (в частности для тех, которые не обладают «магическим числом» атомов и соответствующими размерами) она неожиданно настолько возрастает, что некоторые металлические кластеры начинают воспламеняться при обычных условиях. В каждой такой ситуации наночастица обладает очень большим отношением поверхность/объем, что создает дополнительные возможности для поглощения ею новых компонентов активной поверхностью (рис.200). Многие такие реакции могут служить средством придания материалам новых функциональных возможностей, например возможность использования наночастиц в качестве носителей фармацевтических препаратов или гормонов в живом организме.
СВС – реакции. Суть СВС проста: в смеси порошков разных химических веществ точечно инициируют реакцию синтеза (например, облучая объект лазерным лучом). При протекании реакции выделяется тепло, которое нагревает соседние более холодные слои вещества и также возбуждает в них реакцию. Получается самораспространяющийся процесс: химическая реакция протекает в узкой зоне (фронте), перемещающейся по веществу с большой скоростью. Для таких процессов нужны высокие температуры, близкие к температуре плавления веществ, участвующих в реакции. Но огромное преимущество состоит в том, что эта высокая температура создается в самой системе. Реакции СВС сопровождаются ярким свечением.
Схематично реакцию СВС можно представить так:
Горючее + окислитель →продукт реакции + тепловой эффект.
Примеры СВС- - реакций
1) Zr +C =ZrC
2) Ni + Al = NiAl,
3) 3Si +2N2 = Si2N4
В качестве горючего могут быть использованы Ti, Zr, Hf, V, Nb, Ta, W и др.
В качестве окислителя – C, B, N2, H2, O2, S, и др.
Продукты реакции: - карбиды, бориды, силициды, нитриды, окислы и т.д.
Температура горения может меняться от 8—до 40000С, а линейная скорость от нескольких сотых до нескольких сотен сантиметров в секунду (V= 0,01 – 500см/с).
Итак, инициируемая в одном месте реакция провоцирует волну, при которой химическое превращение, сосредоточенное в зоне, перемещается по смеси порошков. За доли секунды температура повышается до 2000 -30000С, и в проходящей по материалу волне горения получаются химически чистые и однородные продукты.
Сейчас с помощью СВС синтезированы уже сотни соединений. Это карбиды, бориды, силициды, нитриды, гидриды, сульфиды и многие другие соединения. Именно таким образом изготавливают полезные керамики, в том числе сверхпроводящие. Это практически безотходный химический синтез, с помощью которого получают жаростойкие и жаропрочные, сверхтвердые и износостойкие, сверхпроводящие, ферромагнитные, изоляционные и полупроводниковые материалы, способные работать в экстремальных условиях. Нормально работают установки с примерной производительностью 100-200кг/сутки, получены тонны СВС продуктов. Области применения продуктов СВС довольно разнообразны – это алмазно – абразивный инструмент, твердые сплавы, наплавочные материалы, высокотемпературные нагреватели, испарительные элементы, смазочно- охлаждающие жидкости и т.д.
Дата добавления: 2020-10-14; просмотров: 445;











