А. Цихановер А. Хершко И. Роуз
Аарон Цихановер (Aaron Ciechanover) родился в 1947 г. в Хайфе. В 34 года получил докторскую степень по медицине в Израильском технологическом институте (Хайфа). Сейчас Цихановер – профессор отдела биохимии и директор Института медицинских исследований при Израильском технологическом институте.
Аврам Хершко (Avram Hershko) родился в 1937 г. в Карцаге, Венгрия. В 32 года стал доктором медицины в медицинской школе «Хадасса» Иерусалимского университета. В настоящее время Хершко – почетный профессор того же института, где директорствует Цихановер.
Ирвин Роуз (Irwin Rose) родился в Нью-Йорке в 1926 г., докторскую степень защитил в 1952 г. в Университете Чикаго. Специалист в области физиологии и биофизики, работает в Медицинском колледже Университета Калифорнии в Иврине.
Еще не так давно жизнь трактовалась как способ существования белковых тел. И в самом, деле такими телам, вернее, молекулами, насыщена любая клетка живого организма. Это и ферменты, ускоряющие химические реакции; и гормоны, исполняющие роль сигнальных молекул; и сложные соединения, обеспечивающие иммунную защиту организма; и регуляторы многих внутриклеточных процессов. Наконец, сама форма клетки и ее структура поддерживаются именно белками. Почему-то повелось, что исследователей интересовало в первую очередь, как осуществляется и контролируется синтез белков в клетке, а их распаду не уделялось должного внимания. В противоположность этому, нобелевские лауреаты 2004 г. изучали как раз распад (расщепление, деградацию), причем не всякий – гидролиз протеазами с образованием, в конечном счете, аминокислот был известен. Будущих лауреатов привлекла утилизация белков, которая требует энергии. Первым начал исследования в этом направлении Хершко. В 1971 г. он стажировался в лаборатории Г.Томкинса, где изучал деградацию фермента тирозинаминотрансферазы в культивируемых клетках гепатомы. По результатам исследователи предположили, что источником энергии на ранней стадии деградации фермента служит нуклеотид аденозинтрифосфат (АТФ).
В 1978 г. израильские биохимики работали с лизатом ретикулоцитов (содержимых этих клеток, полученным после их разрушения ферментами), в котором изучали зависимый от энергии протеолиз. Чтобы избавиться от гемоглобина, который загрязнял лизат и мешал анализу, они пропустили образец через колонку с целлюлозой и совершенно неожиданно для себя обнаружили, что в результате хроматографии образуются две фракции. По отдельности они не проявляли протеолитической активности, но как только их объединяли, протеолиз, зависимый от АТФ, восстанавливался. В следующем году биохимики определили , что активным компонентом первой фракции был термостабильный полипептид с молекулярной массой около 9000 Да.
Не меньшие сюрпризы преподнесла и вторая фракция образца, которая исследовалась уже сообща – Хершо, Цихановером и Роузом. Вторая фракция в условиях эксперимента в свою очередь делилась на две части: одна содержала очень крупный белковый комплекс, стабилизированный АТФ, другая – ферменты Е1, Е2, Е3. для расщепления белка-субстрата требовались все три фракции.
Совместный путь к Нобелевской премии длился (по публикациям) всего три года – с 1979-го по 1981-й. За это время удалось установить, что термостабильный полипептид из первой фракции может ковалентно соединяться со многими белками, которые содержатся в лизате ретикулоцитов; что с одним и тем же белком связывается не одна молекула полипептида, а несколько, причем взаимодействие происходит через ε-аминогруппы лизинов, имеющихся в полипептиде.
Далее наступил черед изучения фракции, содержащей ферменты Е1-Е3, т.е. ферментную систему, которая обеспечивает «пришивание» термостабильного полипептида к белку-субстрату. Этот полипептид уже был обнаружен (разными исследователями) в клетках всевозможных эукариотических организмов, и в 1980 г. К. Уилкинсон присвоил веществу название убиквитин (лат. ubique – везде, всюду). А если он столь вездесущ, значит, предположили будущие нобелевские лауреаты, протолиз, который требует энергии АТФ и убиквитина, чрезвычайно важен для любой клетки.
Высказав гипотезу о деградации белков как цепи последовательных реакций, биохимики выделили и охарактеризовали ферменты Е1-Е3, пределили место и способ действия каждого из них в этой цепи. Из тщательнейших биохимических работ выяснилось, что энергия АТФ нужна только для активации убиквитина. Активированный, он ковалентно связывается с ферментом Е1 через его сульфгидрильную группу (SH), оттуда передается на фермент Е2 и далее на белок-субстрат. Эту последнюю стадию катализирует фермент Е3 и повторяет реакцию раз за разом, пока не образуется цепочка из нескольких молекул убиквитина. Белок с таким своеобразным ярлыком будет опознан протеасомой – специально предназначенной для протеолиза частицей – и расщеплен ею на пептиды разной длины.
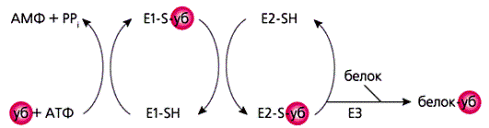
Схема последовательных ферментативных реакций, в ходе которых ярлык-убиквитин «пришивается» к белку-мишени. Только в начальной стадии – для активации убиквитина – необходима энергия АТФ. Активированный убиквитин связывается через сульфгидрильную группу (SH) с ферментом Е1, затем таким же образом – с ферментом Е2. Фермент Е3 катализирует перенос «ярлыка» с Е2 на белковую молекулу. Последняя стадия повторяется несколько раз, и в результате белок оказывается связанным с цепочкой из нескольких молекул убиквитина
Протеасома представляет собой сложнейший белковый комплекс, вероятно, именно она была выделена Хершко, Цихановером и Роузом из второй фракции лизата ретикулоцитов. Почти 10 лет после этого многие исследователи безуспешно пытались выделить протеасому, хотя, как теперь известно, в клетке человека содержится до 30 тыс. этих частиц. На самом деле частицу с протеолитической активностью открывали много раз и давали разные названия, даже в статьях Хершко 90-х годов она значилась как циклосома. Теперь эту протеолитическую машину именуют чаще всего протеасомой. Известно о ней очень многое, существует и «портрет», полученной компьютерной томографией.
Сейчас полностью подтверждено предположение Хершко, Цихановера и Роуза, высказанное ими более 20 лет назад, о важнейшей роли для клетки протеолиза, зависимого от энергии и убиквитина. Дефекты в любом звене системы, обеспечивающей контроль за распадом внутриклеточных белков, обычно приводят к драматическим последствиям, вызывают многие болезни человека. Интерес к изучению этой системы не угас, в ней далеко не все расшифровано. Сейчас уделяется большое внимание генетической стороне системы, т.е. идентификации генов, в которых закодированы структуры всех белковых молекул протеасомы. Кроме того, во многих лабораториях мира исследователи обратились к медицинскому аспекту – пытаются создать лекарства против болезней, связанных с протеасомной деградации белков. И уже есть успехи: проходит, например, клинические испытания один из ингибиторов протеасомы, который в экспериментах проявил активность против множественной миеломы. Так давняя работа лауреатов нобелевской премии по расшифровке подготовительных стадий протеолиза привела к получению фармакологического препарата.
Дата добавления: 2016-05-30; просмотров: 1399;











