НИКОТИНАМИДНЫЕ ДЕГИДРОГЕНАЗЫ (НАДГ)
Небелковая часть этих ферментов представляет собой динуклеотид: НИКОТИНАМИД-АДЕНИНДИНУКЛЕОТИД (НАД+) или НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ (НАДФ+).
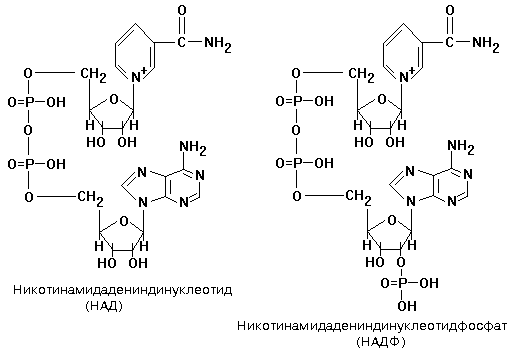
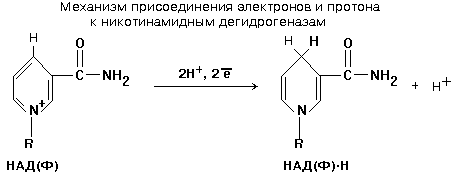
Студенты обязаны знать формулу НАД(Ф) и механизм присоединения к нему водорода. НАД(Ф) содержит производное витамина РР - никотинамид. (см. раздел «Витамины»).
НАД+ и НАДФ+ входят в состав каталитического центра НАДГ. Они являются КОФЕРМЕНТАМИ, так как связаны с белковой частью слабыми типами связей - могут легко диссоциировать. Они присоединяются к белковой части только в момент протекания реакции. Реакция, которую катализируют НАДГ - это реакция окисления субстрата.
Известно около 150 НАДГ, которые различаются по строению белковой части (апофермента).
Апоферменты большей части НАДГ способны присоединять или только НАД, или только НАДФ, и лишь немногие способны соединяться и с тем, и с другим коферментами. НАДГ, участвующие в митохондриальном окислении, находятся в матриксе митохондрий, в отличие от большинства других участников дыхательной цепи, которые встроены во внутреннюю мембрану. НАДГ можно встретить и в цитоплазме клеток. Мембрана митохондрий непроницаема для НАД(Ф), поэтому митохондриальный и цитоплазматический НАД(Ф) никогда не смешиваются. В митохондриях содержится очень много НАД и почти нет НАДФ, а в цитоплазме - наоборот - очень много НАДФ и почти нет НАД.
Из матрикса митохондриальный НАД×Н2 отдает два атома водорода на «комплекс I», встроенный во внутреннюю мембрану митохондрий.
КОМПЛЕКС I
В составе комплекса находится 26 полипептидных цепей общей массой 800 кДа. Комплекс содержит следующие небелковые компоненты: Флавинмононуклеотид (ФМН), 5 центров FeS (железо-серные центры): FeS1a, FeS1b FeS2, FeS3, FeS4.
В транспорте водорода по дыхательной цепи в этом комплексе принимает участие ФМН.
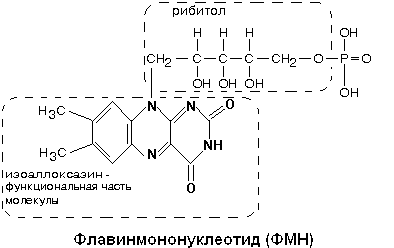
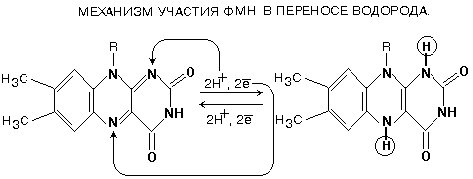
Одновременно с протонами транспортируются и электроны. Наибольшие перепады редокс-потенциала наблюдаются между железо-серными белками, расположенными в следующем порядке:
ФМНÞFeS1aÞFeS1bÞFeS3ÞFeS4ÞFeS2
Комплекс I – интегральный белковый комплекс. Используя энергию, выделяющуюся при переносе электронов по дыхательной цепи, он транспортирует 4 протона из матрикса в межмембранное пространство – комплекс I работает как протонный генератор. Точный механизм этого транспорта до сих пор неизвестен.
Далее комплекс I восстанавливает промежуточный переносчик KoQ (убихинон).
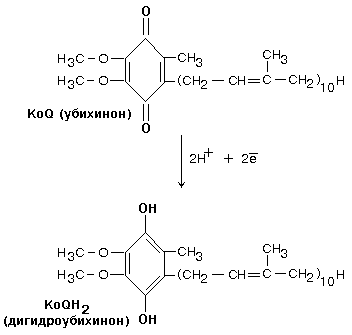
Это жирорастворимое низкомолекулярное вещество, содержащее длинную изопреновую цепь, не имеет белковой части. КоQ принимает водород от комплекса I. Образовавшийся КоQH2 отдает водород на комплекс III.
КОМПЛЕКС III.
В своем составе содержит цитохромы – сложные белки, содержащие небелковый компонент - простетическую группу, сходню по строению с небелковой частью гемоглобина – гемом.
1) Цитохромы b, имеющие в своем составе два типа простетических групп тетрапиррольной структуры - «гем». Известно два гема цитохромов: be, обладающий низким окислительно-восстановительным потенциалом и bh с высоким окислительно-восстановительным потенциалом. Строение простетической группы цитохромов группы b, похожей на гем белка гемоглобина, представлено на рисунке. Его необходимо выучить.
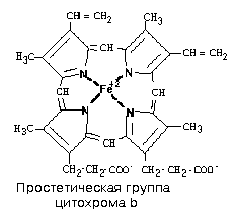 2)FeSIII – железо-серный кластер.
2)FeSIII – железо-серный кластер.
3) Цитохром С1. Имеет в своем составе особый гем типа «с».
Друг от друга цитохромы могут отличаться:
1) Строением белковой части;
2) Значением окислительно-восстановительного потенциала;
3) Строением радикалов, расположенных по периферии гема;
4) Присоединением гема к белковой части – в некоторых случаях гем присоединен к ней ковалентной связью за счет радикалов цистеина, что характерно для цитохромов c1 и c.
От двух атомов водорода, которые переносятся на комплекс III от KoQ, дальше по цепи транспортируются только электроны, два протона (H+)комплекс III выбрасывает в межмембранное пространство вместе с еще одной парой протонов, которые подхватываются комплексом из матрикса. Таким образом, комплекс III в сумме выбрасывает в межмембранное пространство 4 протона. Поэтому комплекс III, как и комплекс I, является протонным генератором, и целью его работы также является создание DmH+.
КОМПЛЕКС IV.
Комплекс IV называется цитохромоксидазой. Он способен захватывать из матрикса 4 протона. Два из них он отправляет в межмембранное пространство, а остальные передает на образование воды.
Благодаря многоступенчатой передаче энергия в дыхательной цепи выделяется не мгновенно, а постепенно (маленькими порциями) при каждой реакции переноса. Эти порции энергии не одинаковы по величине. Их величина определяется разницей между ОВП двух соседних переносчиков. Если эта разница небольшая, то энергии выделяется мало - она рассеивается в виде тепла. Но на нескольких стадиях ее достаточно, чтобы синтезировать макроэргические связи в молекуле АТФ. Такими стадиями являются:
1) НАД/ФАД - разность потенциалов 0.25V.
2) Цитохромы b/cc1 - 0.18V
3) aa3/O-2 - 0.53V.
Значит, на каждую пару атомов водорода, отнятых от субстрата, возможен синтез 3-х молекул АТФ.
 АДФ + Ф + ЭНЕРГИЯ -------> АТФ + Н2О
АДФ + Ф + ЭНЕРГИЯ -------> АТФ + Н2О
Макроэргическая связь - это такая ковалентная связь, при гидролизе которой выделяется не менее 30 кДж/моль энергии. Эта связь обозначается знаком ~.
Синтез АТФ за счет энергии, которая выделяется в системе МтО, называется ОКИСЛИТЕЛЬНЫМ ФОСФОРИЛИРОВАНИЕМ. Основная роль АТФ - обеспечение энергией процесса синтеза АТФ.
Для оценки эффективности работы системы МтО при окислении вычисляют КОЭФФИЦИЕНТ P/O. Он показывает, сколько молекул неорганического фосфата присоединилось к АДФ в расчете на один атом кислорода.
Для главной (полная) цепи Р/О=3 (10H+/2H+(затраты на освобождение АТФ из комплекса с ферментом) + 1H+ (затраты на транспорт фосфата)) = 3,3 (округляют до 3-х)), коэффициент полезного действия системы - 65%, для укороченной P/O=2 (6H+/2H+(затраты на освобождение АТФ из комплекса с ферментом) + 1H+ (затраты на транспорт фосфата)) = 2, для максимально укороченнойP/O=1 (4H+/2H+(затраты на освобождение АТФ из комплекса с ферментом) + 1H+ (затраты на транспорт фосфата)) = 1.
Система МтО потребляет 90% кислорода, поступающего в клетку. При этом в сутки образуется 62 килограмма АТФ. Но в клетках организма содержится всего 20-30 граммов АТФ. Поэтому молекула АТФ в сутки гидролизуется и снова синтезируется в среднем 2500 раз (средняя продолжительность жизни молекулы АТФ - полминуты).
ОСНОВНЫЕ ПРОЦЕССЫ, ДЛЯ КОТОРЫХ ИСПОЛЬЗУЕТСЯ ЭНЕРГИЯ АТФ:
1. Синтез различных веществ.
2. Активный транспорт (транспорт веществ через мембрану против градиента их концентраций). 30% от общего количества расходуемого АТФ приходится на Na+,К+-АТФазу.
3. Механическое движение (мышечная работа).
СИНТЕЗ АТФ.
Во внутренней мембране митохондрий расположен интегральный белковый комплекс – Н+-зависимая АТФ-синтаза seu Н+-зависимая АТФ-аза(два разных названия связаны с полной обратимостью катализируемой реакции), обладающий значительной молекулярной массой – более, чем 500кДа. Состоит из двух субъединиц: FO и F1.
F1 представляет из себя грибовидный вырост на матриксной поверхности внутренней митохондриальной мембраны, FO же пронизывает эту мембрану насквозь. В толще FO расположен протонный канал, позволяющий протонам возвращаться обратно в матрикс по градиенту их концентраций.
F1 способна связывать АДФ и фосфат на своей поверхности с образованием АТФ - без затраты энергии, но обязательно в комплексе с ферментом. Энергия необходима лишь для освобождения АТФ из этого комплекса. Эта энергия выделяется в результате тока протонов через протонный канал FO.
В дыхательной цепи сопряжение абсолютно: ни одно вещество не может окисляться без восстановления другого вещества.
Но при синтезе АТФ сопряжение одностороннее: окисление может идти без фосфорилирования, а фосфорилирование без окисления никогда не идёт. Это означает, что система МтО может работать без синтеза АТФ, но АТФ не может быть синтезирована, если не работает система МтО.
Дата добавления: 2020-03-17; просмотров: 829;











