Неколлагеновые белки межклеточного матрикса соединительной ткани
Наряду с коллагеном, соединительная ткань содержит регуляторные белки, ферменты, а также адгезивные белки, обеспечивающие связывание различных компонентов межклеточного матрикса соединительной ткани как между собой, так и с клеточными мембранами.
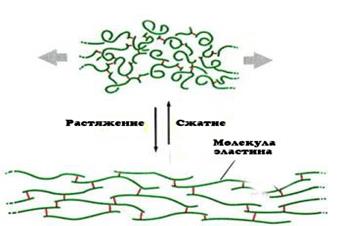
2.1. Эластиншироко представлен в тех типах соединительной ткани, которые наряду с прочностью на разрыв могут подвергаться значительному растяжению, а затем принимают исходные размеры: в коже, кровеносных сосудах, связках, легких (см. схему). Эластин - это белок с молекулярной массой одной полипептидной цепи 70 кДа, которая содержит мало полярных аминокислот; однако богата глицином (27%), аланином (19%), валином (10%), и лейцином (4,7%). В эластине практически отсутствуют цистеин и триптофан и содержится очень мало метионина. Содержание гидроксипролина в эластине приблизительно в 10 раз ниже, чем в коллагене.
 |
Уникальные свойства эластина связаны с наличием в его структуре поперечных сшивок, в образовании которых участвуют остатки лизина двух, трех или четырех отдельных полипептидных цепей. Благодаря таким сшивкам эластин можно растягивать сразу в двух направлениях в отличие от других фибриллярных белков (см. формулу сшивки, образованной четырьмя лизиновыми остатками - десмозина):
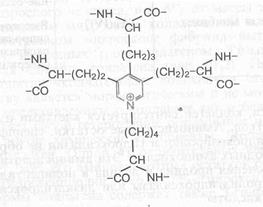 |
Десмозин
Эластин синтезируется как растворимый мономер, молекулы которого принимают почти сферическую форму. Эластичная структура возникает, как в коллагене, в результате постсинтетического наложения межмолекулярных сшивок, в образовании которых принимает участие лизилоксидаза. Нарушения посттрансляционной модификации эластина могут приводить к различным заболеваниям, связанным с вялостью и истонченностью эластичных тканей. Причинами этих нарушений могут быть снижение активности лизилоксидазы, вызванное наследственными причинами или дефицитом меди, а также нарушение всасывания меди в кишечнике.
Основным ферментом, распада эластина, является эластаза нейтрофилов, которая наряду с эластином способна расщеплять другие белки, в частности, коллаген, протеогликаны, гемоглобин. В норме эластаза не разрушает ткани из-за присутствия в крови синтезируемого в печени ингибитора протеиназ, носящего название α1-антитрипсина. При возникновении очага воспаления в нем наблюдается возрастание эластазной активности, за счет притока нейтрофилов, а также увеличение уровня свободных радикалов, генерируемых нейтрофилами. При незначительных поражениях эластических тканей организм способен справиться с развившимся окислительным стрессом, однако при массивных поражениях, например, при обширных ожогах кожи, ткани подвергаются повышенному окислительному стрессу.
2.2. Фибронектинявляется одним из неколлагеновых белков, обеспечивающим связывание коллагена, фибрина и гликозаминогликанов с клетками. Он выполняет интегрирующую роль при построении межклеточного матрикса. Фибронектин синтезируется и секретируется в межклеточный матрикс многими клетками, например, фибробластами. Он состоит из двух одинаковых субъединиц, связанных между собой дисульфидными связями, расположенными вблизи С-концов. В каждой цепи фибронектина содержатся домены, способные связывать: а) коллаген; б) протеогликаны; в) гиалуроновую кислоту; г) углеводы клеточных мембран; д) гепарин; е) фермент глутамилтрансферазу. Фибронектин участвует в различных процессах: адгезии и перемещения эпителиальных и мезенхимальных клеток, стимуляции пролиферации эмбриональных и опухолевых клеток, дифференцировке и поддержании цитоскелета клеток, в воспалительных и репаративных процессах. Каждая субъединица фибронектина содержит последовательность Арг-Гли-Асп (RGD), участвующую в присоединении к клеточным рецепторам – интегринам.
2.3. Интегрины– белковые мембранные рецепторы, состоящие из двух субъединиц. Они встроены в плазматическую мембрану, способны связывать белки, содержащие RGD-последовательности и участвовать в передаче информации из внеклеточного пространства внутрь клетки.
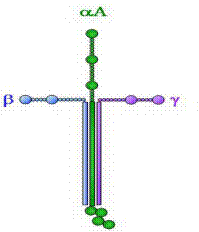
2.4. Ламининыявляются наиболее распространенными гликопротеинами базальных мембран. Они состоят из трех полипептидных цепей (a, b, g), которые укладываются в пространстве в крестообразную структуру, на различных ответвлениях которой имеются домены (изображены на рисунке кружками), способные взаимодействовать практическими со всеми структурными компонентами базальных мембран: коллагеном IV типа, нидогеном, гепарансодержащими протеогликанами, а также с белковыми рецепторами клеток. Ламинины выступают в роли факторов адгезии, роста, дифференцировки и хемотаксиса клеток. Они необходимы для структурной организации дентина и связывания тканей пародонта с цементом корня зуба.
Дата добавления: 2020-10-01; просмотров: 545;











