Терпены и терпеноиды
Терпены – природные соединения преимущественно растительного происхождения, отвечающие формуле (С5Н8)n, где n≥2.
В соответствии с номенклатурой ИЮПАК термином «Терпены» обозначают углеводороды.
Терпеноиды – это кислородсодержащие производные терпенов (спирты, альдегиды, кетоны, сложные эфиры). Оба понятия как и сами соединения очень тесно взаимосвязаны между собой и поэтому принципиальной разницы в терминологии можно не делать.
Терпены и терпеноиды широко распространены в растительном мире: это, прежде всего, компоненты эфирных масел, живицы хвойных.
Эфирные масла (душистые масла) – многокомпонентные смеси летучих органических соединений, содержащие преимущественно терпены и терпеноиды и способные перегоняться с водяным паром.
Эфирные масла характеризуются приятным запахом и обусловливают аромат всех пахнущих растений (жасмин, роза, лаванда, кориандр, чабрец, полынь, гвоздика и т.д.).
В отличие от жирных масел, эфирные масла, будучи нанесёнными на бумагу, быстро испаряются и не оставляют жирных пятен.
Исторически сложившийся подход к определению понятия терпены связан с тем, что абсолютное большинство известных соединений этой группы отвечали формуле (С5Н8)n и минимальное число атомов углерода при этом составляло 10. Однако, благодаря очень чувствительным инструментальным методам исследования было установлено, что в большинстве эфирномасличных растений в незначительных количествах присутствует изопрен – С5Н8. Современная классификация терпенов представлена в таблице 23.1.
Таблица 23.1. Классификация терпенов – (С5Н8)n.
| Тип | Значение n | Число углеродных атомов |
| Гемитерпены | ||
| Монотерпены | ||
| Сесквитерпены | ||
| Дитерпены | ||
| Сестерпены | ||
| Тритерпены | ||
| Тетратерпены | ||
| Политерпены | 1,4∙103 – 0,6∙105 каучуки | от 7∙103 до 3∙105 |
Монотерпены
Среди всех изопреноидов монотерпены наиболее распространены и представляют особую ценность для производства эфирных масел, компонентами которых они являются.
По строению углеродного скелета их подразделяют на следующие группы:
- ациклические монотерпены;
- моноциклические монотерпены;
- бициклические монотерпены.
Ациклические монотерпены обычно представлены ненасыщенными спиртами, реже альдегидами. Очень редко встречаются соединения с карбоксигруппой.
Углеродный скелет ациклических монотерпенов соответствует 2,6-диметилоктану, рассматриваемому в качестве структурного предшественника. Ниже приведены структуры некоторых ациклических монотерпенов. В скобках указаны наиболее богатые источники этих соединений:

Эфирные масла, содержащие перечисленные выше ациклические монотерпены, используют в парфюмерии и пищевой промышленности.
Цитраль применяется в глазной практике при кератитах и конъюнктивитах. Оказывает болеутоляющее и противовоспалительное действие.
Цитраль является исходным веществом для синтеза ретинола (витамина А).
Моноциклические монотерпены. Наиболее распространёнными из этой группы являются соединения ментанового ряда:

Ментан в природе не встречается. Синтетически его можно получить гидрированием цимола (п-метилизопропилбензола):
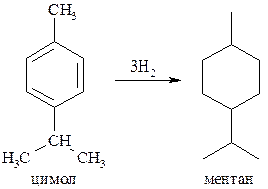
Гидроксипроизводные ментанового ряда широко распространены, поскольку являются составными компонентами многих эфирных масел. Наибольшее практическое значение имеют ментол – ментан-3-ол, а также терпин или ментандиол-1,8.
Ментол. В эфирном масле мяты перечной примерно 40-70% приходится на долю ментола. Получают ментол из эфирного масла мяты перечной или же гидрированием тимола:
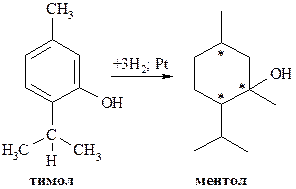
Ментол имеет три асимметрических атома углерода (в формуле они отмечены звёздочками), поэтому обладает оптической активностью.
Применяется наружно как отвлекающее, антисептическое и противовоспалительное средство в составе мягких лекарственных форм или в виде аэрозолей для ингаляций. Внутрь назначают в качестве успокоительного средства.
Ментол используется для получения препарата «Валидол», представляющего собой раствор ментола 25% в ментиловом эфире изовалериановой кислоты. Препарат оказывает успокаивающее влияние на ЦНС и обладает умеренным рефлекторным сосудорасширяющим действием.
В промышленности ментол получают из м-крезола, который вначале алкилируется с помощью изопропилхлорида или пропанола-2, а затем образующийся тимол восстанавливается до ментола.
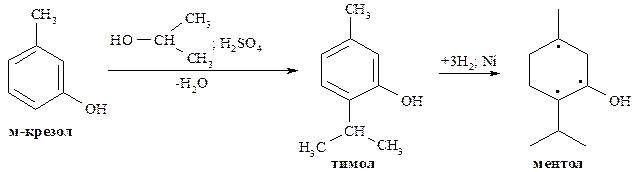
Далее ментол переводят в ментиловый эфир изовалериановой кислоты:
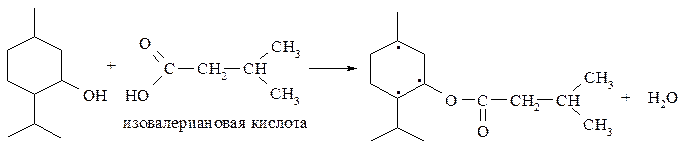
В процессе синтеза образуется смесь восьми стереоизомеров, из которой необходимый левовращающий ментол отделяют с помощью химических и физико-химических методов.
Будучи вторичным спиртом, ментол окисляется до кетона – ментона:

Ментон содержится в мятном, гераниевом и многих других эфирных маслах.
Терпин или ментандиол-1,8. Является двухатомным спиртом. В природных эфирных маслах практически не встречается. Его получают из пинена – важнейшего компонента скипидаров (см. ниже, бициклические монотерпены). В процессе получения терпин кристаллизуется в виде моногидрата, называемого терпингидратом.
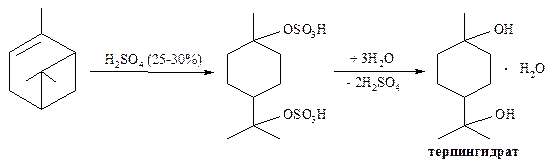
Терпингидрат применяется внутрь как отхаркивающее средство при хронических бронхитах.
При действии водоотнимающих средств на терпингидрат можно получить терпинеолы, а также цинеол:
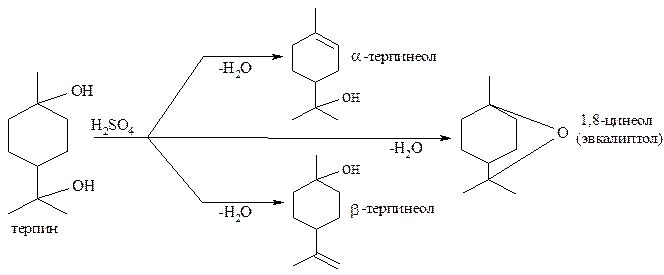
Цинеол или эвкалиптол является внутренним простым эфиром и имеет характерный «камфарный» запах, входит в состав эфирных масел эвкалиптов (до 70%), цитварной полыни (до 80%), благородного лавра (до 50%).
Терпинеолы имеют приятный запах: α-терпинеол – запах сирени; β-терпинеол – запах гиацинта.
При дегидратации α-терпинеола образуется сложная смесь изомерных ментадиенов – лимонен, терпинолен, ментадиен, терпинены, структуры которых были приведены выше.
Оптически активные формы лимонена входят в состав эфирных масел: (+)-лимонен содержится в цитрусовом и тминном маслах, а (-)-лимонен входит в состав живицы хвойных
Рацемат лимонена называется дипентеном. Замещённые дипентены является психоактивными веществами.
Бициклические монотерпены. Ниже представлены структуры углеводородов, лежащих в основе бициклических монотерпенов:
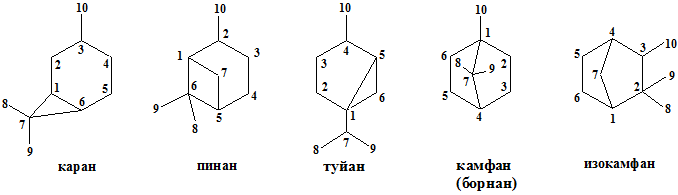
Большинство монотерпенов с бициклическим углеродным скелетом содержится в живицах хвойных.
Живица или терпентин представляет собой жидкую смолу, содержащуюся в смоляных ходах, пронизывающих древесину и вторичную кору сосны. По существу – это бальзам, представляющий собой раствор смолы (канифоли) в эфирном масле (скипидаре).
Очищенный скипидар содержит до 75% пинена.
α-Пинен. Является преобладающим компонентом скипидара. Характеризуется правым вращением. Его структурный изомер – β-пинен также содержится в живице и характеризуется левым вращением. У обоих пиненов по два асимметрических углеродных атома:

Благодаря высокому содержанию в смоле хвойных, пинены служат исходными соединениями для получения многочисленных производных, в основе которых лежат бициклические монотерпены.
Выше было показано, что из α-пинена можно получить терпин и далее терпинеолы и эвкалиптол.
Значительное количество α-пинена используется в промышленности для синтеза лекарственного препарата – камфоры.
В медицинской практике используют:
- натуральную правовращающую камфору, получаемую из камфорного дерева – Cinnamomum camphora (L.) Nees et Eberm.;
- синтетическую левовращающую камфору, получаемую из пихтового масла;
- камфору рацемическую.

Потребность в камфоре не удовлетворяется природными источниками, тем более, что не во всех странах произрастает камфорное дерево. В связи с этим разработаны синтетические и полусинтетические способы получения камфоры.
Левовращающую камфору можно получить из борнилацетата, содержащегося в пихтовом масле (30-40%).
Борнилацетат получают путём фракционной перегонки масла, гидролизуют (омыляют) гидроксидом натрия, после чего окисляют и получают камфору:

Синтетическую камфору (рацемическую) можно получать из пинена, содержащегося в живице по способу В.Е. Тищенко. Пинен в присутствии катализатора – оксида титана (IV) изомеризуется в камфен, который взаимодействует с муравьиной кислотой с образованием борнилформиата. Далее борнилформиат подвергается гидролизу, а полученный спирт борнеол окисляют до камфоры. Ниже приводится общая схема синтеза по Тищенко:
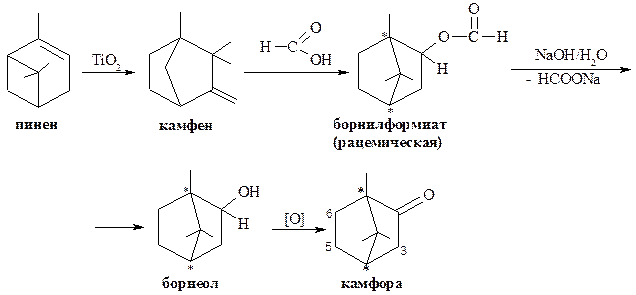
Камфора является кетоном, поэтому по карбонильной группе вступает в реакции, характерные для кетонов, например, образование оксимов, фенилгидразонов и т.д.
Карбонильная группа оказывает значительное влияние на соседнюю метиленовую группу (положение С-3), повышая подвижность атомов водорода. Данное свойство используется при синтезе 3-бромкамфоры:
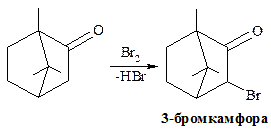
Камфору применяют в качестве стимулятора ЦНС и кардиотонического средства.
Бромкамфора оказывает успокаивающее действие, а также улучшает сердечную деятельность.
Дитерпены
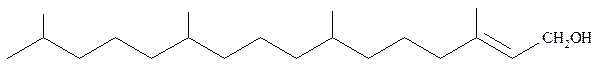
По репрезентативности представителей отдельных групп дитерпены значительно уступают монотерпенам и сесквитерпенам. Ациклические дитерпены практически представлены единичными представителями, среди которых следует отметить фитол, относящийся к дитерпеновым спиртам. Впервые его получили гидролизом хлорофилла:
Доминирующим компонентом нелетучей части живицы хвойных – канифоли является абиетиновая кислота. Наряду с изомерными ей кислотами входит в группу смоляных кислот.

К группе дитерпенов относятся витамины группы А1, представляющие собой семейство из трёх соединений – ретинола, ретиналя и ретиноевой кислоты:

В основном состоянии все три соединения имеют транс-конфигурацию двойных связей, что наглядно представлено в структурной формуле. Характерно, что благодаря такой своеобразной сопряжённой системе, витамины группы А имеют яркую окраску от жёлтой до оранжевой.
Ретинол, будучи аллильным спиртом, легко окисляется до альдегида –ретиналя и далее до ретиноевой кислоты.
Ретиналь способен взаимодействовать с ε-аминогруппой аминокислотного фрагмента лизина белка опсина, в результате чего образуется хромопротеид – родопсин (зрительный пурпур), выполняющий функцию светочувствительного компонента нашей зрительной системы. Поглощая квант света, остаток транс-ретиналя в родопсине переходит в 11-цис-ретиналь:

Структурно близкими к витаминам группы А1 оказались каротиноиды (или каротиноидные пигменты), которые впервые были выделены из моркови (Daucus carota) в 1831 году Цветом М.С.
Каротиноиды относятся к тетратерпенам – С40Н56 и представляют собой полиеновые сопряжённые системы. Они содержатся в различных органах растений и выполняют важные биологические функции, в том числе, участие в процессах фотосинтеза и светозащитная функция.
Наибольшее значение с точки зрения биологических свойств имеет β-каротин, который содержится в зелёных растениях.
Молекула β-каротина содержит два 1,1,5-триметилциклогексеновых кольца, идентичных кольцу β-ионона:

Обращает на себя внимание и тот факт, что аналогичное триметилциклогексеновое кольцо содержится и в молекуле витамина А, структура которого была рассмотрена выше.
В β-каротине оба триметилциклогексеновых кольца соединены между собой цепью из 18 углеродных атомов, представляющих собой сопряжённую систему с чередующимися простыми и двойными связями.
Для сравнения: витамин А1 (см. выше) содержит одно 1,1,5-триметилциклогексеновое кольцо и сопряжённую боковую цепь из 9 углеродных атомов.
Было установлено, что в организме под влиянием фермента 15,15’-оксигеназы молекула β-каротина расщепляется на две молекулы ретиналя, откуда следует, что он является провитамином А:

Тритерпены
По разнообразию структурных типов углеводородов соединения данной группы значительно уступают остальным изопреноидам. Однако, по распространённости тритерпеноиды превосходят не только изопреноиды, но и очень многие группы природных соединений.
В настоящее время описаны многочисленные производные тритерпенов, которые выделены не только из растений, но и из микроорганизмов, морских организмов, животных, а также найдены в органических геологических сферах (нефть, осадочные породы).
Другой важной особенностью тритерпенов является то обстоятельство, что углеродный скелет этих соединений может претерпевать очень существенные изменения, приводящие к формированию биологически важнейшей группы веществ растительного и животного происхождения – стероидов.
В растениях тритерпены обычно находятся в виде кислородосодержащих производных (спирты, альдегиды, кетоны, кислоты, эфиры), а также их гликозидов, называемых сапонинами. Агликоны сапонинов принято называть сапогенинами. Гликозиды тритерпеновых сапонинов образованы за счёт О-гликозидной связи. Наиболее распространёнными являются гликозиды олеаноловой кислоты, которая относится к тритерпеноидам типа олеанана. В растениях семейства губоцветные и розоцветные чаще встречается урсоловая кислота (тип урсана).
Биогенетическим предшественником тритерпенов (следовательно, стероидов) является сквален – единственный ациклический тритерпен из которого далее формируются многочисленные структурные типы рассматриваемой группы изопреноидов:

Тритерпеноиды и их гликозиды характеризуются широким спектром биологической активности. Они регулируют углеводный и липидный обмен, характеризуются гиполипидемическим и гипохолестеринемическим действием, противоопухолевым, иммуномодулирующим и противовирусным свойством. Обладают гепатопротекторным действием, улучшают мозговое кровообращение.
Чаще всего перечисленные биологические свойства пока описаны для соединений, которые наиболее распространены и доступны с точки зрения их количественного содержания в конкретном растении. Они приведены ниже:

| Олеаноловая кислота Содержится в плодах облепихи, в аралии маньчжурской, в сахарной свекле, шалфее, чернике, клюкве. |
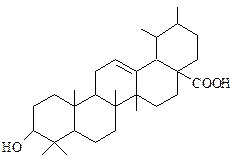
| Урсоловая кислота Содержится в плодах облепихи, яблоках, клюкве, чернике, шалфее и в большинстве растений семейства губоцветных. |

| Глицерретовая кислота В виде гликозида – глицирризиновой кислоты содержится в большишх количествах в солодке гладкой и солодке уральской. |
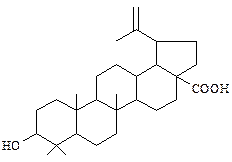
| Бетулиновая кислота Наибольшее количество этой кислоты и соответствующего ей первичного спирта – бетулинола содержится в коре берёзы (от 10 до 35%). |
К сожалению, объём учебной программы не позволяет шире освещать материал, касающийся тритерпеноидов.
Стероиды
Стероиды – это обширная группа природных соединений растительного и животного происхождения, биогенетическим предшественником которых является сквален.
В основе всех стероидов лежит углеводород гонан (или иначе стеран), представляющий собой циклопентанпергидрофенантрен. В соответствии с правилами ИЮПАК основные типы углеводородного скелета стероидов обозначают следующими тривиальными названиями:

Дата добавления: 2020-10-01; просмотров: 2239;











