Диаграммы состояния сплавов и закономерности Курнакова.
Если отрезок оси абсцисс разделить на сто частей, то точки этого отрезка будут соответствовать процентному составу двойных сплавов. Если по оси ординат отложить температуру, то получим координатную сетку диаграммы фазового состояния. Каждая точка диаграммы состояния соответствует определенному составу сплава при заданной температуре. Линии на диаграмме состояния отмечают температуры изменения фазового состава, а поля, ограниченные этими линиями, характеризуют области существования различных фазовых состояний.
Диаграммы состояния показывают изменения фазового состояния сплавов при изменении их состава и температуры, а также позволяют предсказывать свойства сплавов. Связь между составом сплава и его свойствами для различных типов диаграмм состояния впервые была установлена Н. С. Курнаковым и получила название закономерностей Курнакова. Рассмотрим некоторые типы диаграмм состояния и связь свойств сплавов с их составом.
Как отмечалось выше, при изоморфности кристаллических решеток, близости строения валентных электронных оболочек атомов и малой разнице в размерах атомов в твердом состоянии элементы образуют неограниченные твердые растворы. Диаграммы состояния таких сплавов выглядят, как показано на рис. 22 а.
 Рис.22. Диаграммы состояния и зависимость свойств от состава для случаев:
а), б) неограниченной растворимости компонентов в твердом состоянии;
в), г) отсутствия растворимости компонентов в твердом состоянии;
д), е) ограниченной растворимости компонентов в твердом состоянии.
Рис.22. Диаграммы состояния и зависимость свойств от состава для случаев:
а), б) неограниченной растворимости компонентов в твердом состоянии;
в), г) отсутствия растворимости компонентов в твердом состоянии;
д), е) ограниченной растворимости компонентов в твердом состоянии.
|
Верхняя линия на диаграмме состояния представляет собой геометрическое место точек начала кристаллизации или конца плавления - линию ликвидус. Выше этой линии все сплавы находятся в однофазном - жидком состоянии. Нижняя линия является геометрическим местом точек конца кристаллизации или начала плавления - линия солидус. Ниже этой линии все сплавы также в однофазном - твердом состоянии. Поскольку при изменении состава сплавов фазовое состояние при низких температурах не меняется, то зависимость свойств от состава имеет вид плавной линии с максимумом. Зависимость свойств от состава (прочности, удельного электрического сопротивления, твердости) показана на рис. 22 б). Самостоятельно объясните зависимость свойств от состава, опираясь на представления о влиянии точеных дефектов на механические и электрические свойства металлических материалов.
Диаграмма состояния системы для случая, когда компоненты полностью не растворяются друг в друге в твердом состоянии и растворимы в жидком состоянии, показана на рис. 22 в). В данном случае линия ликвидус выглядит в виде ломаной, причем при некотором составе, называемом эвтектическим (от греческого слова эвтектикос - легкоплавкий), линия ликвидус касается линии солидус. Линия солидус представляет собой горизонтальную линию. Ниже линии солидус в сплава имеется две твердые фазы, являющиеся чистыми компонентами сплава. Поскольку компоненты не растворимы друг в друге, то свойства линейно меняются при изменении состава в соответствии с тем, как меняется количество фаз. Однако вблизи эвтектического состава наблюдается отклонение от линейного закона. Это связано с тем, что при кристаллизации эвтектических сплавов из жидкости одновременно выпадают две твердые фазы, и формируется мелкозернистая структура. Измельчение зерен ведет за собой увеличение электрического сопротивления и прочности эвтектических сплавов.
Для систем сплавов с ограниченной растворимостью характерны диаграммы состояния, показанные на рис. 22 д). В таких системах имеются две области существования фаз, представляющих раствор одного компонента в другом, и область существования смеси двух фаз. При составах, соответствующих областям существования твердых растворов на основе какого-либо компонента, изменения свойств аналогично изменению свойств в системах с неограниченной растворимостью компонентов, а в областях составов, соответствующих двухфазным смесям, изменение состава ведет к изменению свойств, характерному для систем с нерастворимыми в твердом состоянии компонентами.
51.Точечные дефекты кристаллической решетки и их влияние на свойства материалов.
К ним относятся атомы инородных элементов (легирующих элементом или примесей), межузельные атомы (атомы основного элемента, по каким-либо причинам покинувшие узлы кристаллической решетки и застрявшие в междоузлиях), вакансии или не занятые атомами узлы кристаллической решетки. Точечные дефекты показаны на рисунке 10.
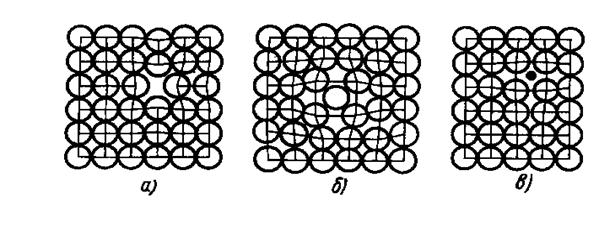 Рис. 10.Схематическое изображение точечных дефектов кристаллической решетки:
а) – вакансия, б) – межузельный атом, в) – чужеродный атом.
Рис. 10.Схематическое изображение точечных дефектов кристаллической решетки:
а) – вакансия, б) – межузельный атом, в) – чужеродный атом.
|
Представление о вакансиях было впервые введено Я. И. Френкелем для объяснения процессов диффузии в металлах - материалах с плотноупакованной кристаллической решеткой. При наличии в кристаллической решетки вакансии атом может перескочить из узла решетки в вакантное место. Тем самым вакансия смещается, и процесс диффузии можно описывать как последовательное перемещение атомов или как движение вакансий. Такой подход хорошо объясняет температурную зависимость диффузии. С ростом температуры увеличивается связанная энергия системы и растет концентрация вакансий, поэтому с ростом температуры активизируется диффузия.
Согласно модели Френкеля, при образовании вакансий атом из узла кристаллической решетки перепрыгивает в междоузлие, и появляется пара дефектов - вакансия и межузельный атом, или пара Френкеля. Несколько позже Шоттки оценил энергию упругих искажений решетки вблизи вакансии и вблизи межузельного атома и показал, что энергия упругих искажений решетки вблизи межузельного атома существенно больше энергии искажений вблизи вакансии. Это позволило ему предложить другой механизм образования вакансий. Атом выходит на поверхность кристалла, и образующаяся вакансия мигрирует (перемещается) в глубь кристалла. Совершенно очевидно, что вероятность образования вакансий по механизму Шоттки существенно выше вероятности образования вакансий по механизму Френкеля.
По современным представлениям, наиболее вероятным механизмом образования вакансий является их испускание границами зерен или дислокациями (см. ниже).
Наличие точечных дефектов оказывает влияние не только на диффузионные процессы в материалах, но и на их электрические свойства. В металлических материалах основным носителем заряда являются свободные электроны. Поскольку кристаллическая решетка металлов упакована плотно, то распространение электронов удобнее всего представить в виде движения электронной волны. При взаимодействии электронной волны с узлами кристаллической решетки, электронная волна передает энергию находящимся в них ионам. Поглотив энергию электронной волны, ионы возбуждаются, колеблются и распространяют во все стороны дифрагированные электронные волны. Дифрагированные волны интерферируют, и образуется новая волна. В том случае, когда кристаллическая решетка правильна, ионы являются когерентными источниками дифрагированные волн, поэтому амплитуды дифрагированных волн суммируются, и формируется новая волна, амплитуда которой равна амплитуде исходной волны (рис. 11,а).
Энергия волны пропорциональна квадрату ее амплитуды, таким образом, в правильной кристаллической решетке электронная волна движется без потерь, и удельное электрическое сопротивление материала с идеальной кристаллической решеткой равно нулю. Появление в кристаллической решетке дефектов приводит к смещению некоторых ионов из равновесных положений, и дифрагированные волны становятся некогерентными (рис. 11,б). При сложении некогерентных волн амплитуда результирующей волны оказывается меньше амплитуды падающей волны, в результате у металла удельное электросопротивление становится отличным от нуля. С ростом температуры концентрация вакансий растет, а следовательно, увеличивается удельное электросопротивление. Аналогичным образом удельное электросопротивление растет при легировании металлов вследствие появления атомов примесей, искажающих кристаллическую решетку.
 Рис.11. а) Дифракция электронной волны на правильной кристаллической решетке. б) Дифракция электронной волны на искаженной решетке
Рис.11. а) Дифракция электронной волны на правильной кристаллической решетке. б) Дифракция электронной волны на искаженной решетке
|
В материалах с ионной связью между атомами основным носителем заряда являются ионы. При появлении вакансий перемещение ионов облегчается, а следовательно, падает удельное электросопротивление. При появлении в материале примесей кристаллическая решетка искажается, энергия материала локально повышается, что способствует облегчению выхода иона из потенциальной ямы. Таким образом, появление любых точечных дефектов ведет к снижению электросопротивления материалов с ионной связью.
В материалах с ковалентной связью присутствие вакансий приводит к обрыву ковалентной связи и появлению на валентной оболочке атома неспаренного электрона. Наличие неспаренных электронов энергетически невыгодно, и атом теряет его. Таким образом, в материале появляются два носителя заряда: отрицательно заряженный свободный (делокализованный) электрон и положительно заряженная дырка. Следовательно, увеличение концентрации вакансий ведет к падению удельного электрического сопротивления материалов с ковалентной связью. Влияние легирующих элементов на электропроводность материалов достаточно сложно и будет подробно рассмотрено при изучении полупроводниковых материалов. В общем случае следует отметить, что присутствие неизовалентных примесей ведет к появлению в материале дырок или свободных электронов, то есть к повышению концентрации носителей заряда.
50. Типы химических связей
Для облегчения понимания межатомного взаимодействия мы будем рассматривать типы химической связи в несколько упрощенном виде, а именно, рассмотрим: а) гомеополярную, или ковалентную связь, б) гетерополярную, или ионную связь, в) металлическую связь и г) поляризационную связь, или связь Ван-дер-Ваальса.
Ковалентная связь. Ковалентная связь образуется между атомами одного или нескольких химических элементов с близкими ионизационными потенциалами. В чистом виде ковалентная связь реализуется при взаимодействии элементов с наполовину заполненными электронными оболочками. Из квантовой химии следует, что система из положительно заряженного ядра и отрицательно заряженных электронных оболочек имеет минимальную энергию в том случае, когда электронные оболочки заполнены полностью. Поэтому атомы с наполовину заполненными электронными оболочками обмениваются электронами. При этом образуются пары электронов с противоположно направленными спиновыми магнитными моментами, причем эти пары принадлежат обоим соседним атомам.
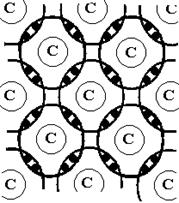 Рис. 3. Схема образования ковалентной связи
Рис. 3. Схема образования ковалентной связи
|
Появление между положительно заряженными ионами пары отрицательно заряженных электронов приводит к тому, что оба иона притягиваются к обобществленным электронам и, тем самым, притягиваются друг к другу. Каждый атом взаимодействует с ограниченным числом соседей, причем число соседей равно числу валентных электронов атома. Следовательно, ковалентная связь насыщенна. Кроме того, атом взаимодействует только с теми соседями, с которыми он обменялся электронами, то есть ковалентная связь направленна.
Отношение размера положительно заряженного ядра к размеру валентной электронной оболочки чрезвычайно мало, поэтому при анализе силы притяжения можно считать, что взаимодействуют точечные заряды, то есть сила притяжения описывается простейшим видом кулоновского закона: сила притяжения обратно пропорциональна квадрату расстояния между зарядами. При сближении атомов начинается взаимное отталкивание внутренних электронных оболочек, и отталкивание атомов описывается более сложным законом: сила отталкивания обратно пропорциональна расстоянию между атомами в степени n, где n >2.
Увеличение порядкового номера элемента ведет к росту количества электронных оболочек, экранирующих взаимодействие положительно заряженных ядер с валентными электронами. Поэтому снижается сила взаимного притяжения и уменьшается глубина потенциальной ямы. В результате, с ростом порядкового номера элемента падает температура плавления, растет коэффициент теплового расширения, уменьшается модуль упругости.
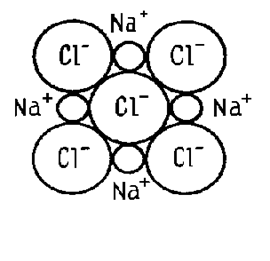 Рис. 3. Схема образования ионной связи
Рис. 3. Схема образования ионной связи
|
Ионная связь. Ионная связь образуется при взаимодействии атомов с малым количеством валентных электронов и атомов с большим количеством электронов на валентных оболочках. При этом наружные электроны атомов с низкими потенциалами ионизации переходят на валентные оболочки атомов с высокими ионизационными потенциалами. В результате образуются положительно и отрицательно заряженные ионы, взаимно притягивающиеся электростатическими силами. Ионная связь ненасыщенна, поскольку каждый из отрицательно заряженных ионов притягивает к себе положительно заряженные, а каждый из положительно заряженных ионов притягивает к себе все отрицательно заряженные. Однако ионная связь направлена, поскольку ион притягивает к себе разноименно заряженные ионы и отталкивает одноименно заряженные.
Уменьшение размера иона и увеличение его заряда ведет к росту энергии связи, а следовательно, к росту температуру плавления материала, уменьшению коэффициента теплового расширения и к увеличению модуля упругости.
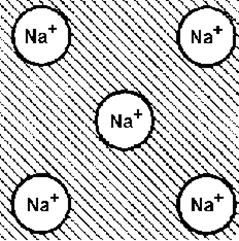
|
| Рис. 5. Схема образования металлической связи. |
Металлическая связь образуется между атомами одного или нескольких химических элементов, у которых валентные электронные оболочки застроены меньше чем на половину. Поскольку энергия иона минимальна при полностью заполненной внешней оболочке, атомы отдают внешние валентные электроны и превращаются в положительно заряженные ионы, между которыми находятся свободные электроны (электронный газ).
Каждый из положительно заряженных ионов притягивается к свободным электронам, и, тем самым, ионы притягиваются друг к другу. Металлическая связь ненаправленна и ненасыщенна, и число ближайших соседей у иона определяется в основном геометрическим и энергетическими факторами. Следовательно, кристаллические решетки металлов упакованы плотно. Под действием электрического поля не связанные с ионами электроны перемещаются, то есть металлы обладают высокой электропроводностью. Свободные электроны могут легко ускоряться и замедляться, то есть менять свою кинетическую энергию. Вследствие этого металлические материалы поглощают кванты электромагнитного поля любой энергии, то есть металлы непрозрачны для радио- и световых волн в широком диапазоне частот. Поглотив квант электромагнитного поля, свободный электрон возбуждается, и, переходя в стационарное состояние, испускает аналогичный квант. Иначе говоря, металлические материалы отражают радио- и световые волны. Несколько позже докажем, что плотно упакованная решетка металлов является причиной их высокой пластичности. По определению М.В. Ломоносова: «Металлы суть светлые тела кои ковать можно".
Поляризационная связь, или связь Ван-дер-Ваальса. Образуется при сближении молекул или атомов инертных газов. Рассмотрим возникновение поляризационной связи на примере инертных атомов.
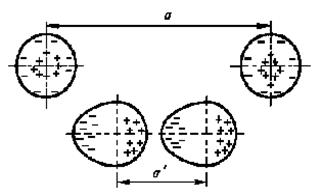
У одиночного атома электронная оболочка симметрична. При сближении двух атомов их электронные оболочки электрически взаимодействуют и деформируются (см. рис. 6). В итоге атомы превращаются в диполи, которые взаимно притягиваются. Чем больше порядковый номер атома, тем больше у него электронных оболочек, а следовательно, связь валентных электронов с ядром ослабевает, и деформировать ее становится легче. Следовательно, возрастает дипольный момент атома и увеличивается энергия связи между атомами. Поэтому температура кипения тяжелых инертных газов заметно выше температуры кипения легких газов.
|
| Рис. 6 Схема образования диполей при сближении нейтральных атомов |
Аналогичные процессы происходят и при сближении электрически нейтральных молекул. Причем чем выше молекулярный вес, тем больший дипольный момент молекул и выше энергия связи. Поэтому вещества с низким молекулярным весом при комнатной температуре являются газами, вещества с большим молекулярным весом - жидкостями, а вещества с еще большим молекулярным весом - твердыми телами.
Важно иметь в виду, что в одном и том же материале одновременно могут реализовываться несколько типов химических связей. Так, внутри молекулы полиэтилена связь ковалентная, а между молекулами поляризационная. В алмазе атомы углерода связаны ковалентной связью, а у графита три электрона образуют ковалентную связь, один электрон идет на образование металлической связи, и образующиеся плоские молекулы связаны поляризационной связью.
В ряде случаев наблюдается изменение типа связи при изменении внешних условий. Так, олово является элементом четвертой группы, и в нем должна реализовываться ковалентная связь, но у олова пять электронных оболочек, и валентные электроны слабо связаны с ядром. Поэтому при термическом возбуждении электроны отрываются от атомов, и связь становится металлической. До температуры 13°С межатомная связь в олове ковалентная, и он является типичным полупроводником - «серое» олово. Выше 13°С связь становится металлической, и олово ведет себя как типичный металл – «белое» олово. Важно отметить, что превращение белого олова в серое олово не может произойти строго при 13°С. Это вызвано существенным различием в плотности упаковки атомов. При перестройке кристаллических решеток в материале появляются упругие напряжения, которые повышают энергию системы. Поэтому превращение начинается при существенном переохлаждении. Упругие напряжения, возникающие при превращении, разрушают материал, поэтому серое олово существует в виде порошка. Превращение белого олова в серое было причиной гибели экспедиции Роберта Скотта. Поскольку канистры с горючим были пропаяны оловом, то при охлаждении белое олово превратилось в серое и горючее вытекло.
49. Сегнетоэлектрики и их применение.
В сегнетоэлектриках в определенном диапазоне температур наблюдается спонтанная или самопроизвольная поляризация. Название эта группа диэлектриков получила по предложению И.В. Курчатова от сегнетовой соли (двойная калиево-натриевая соль винно-каменной кислоты KNaC4H4ґ4H2O), в кристаллах которой впервые была обнаружена спонтанная поляризация. Поскольку свойства сегнетоэлектриков во многом аналогичны свойствам ферромагнетиков, за рубежом их часто называют ферроэлектриками. В 1944 г. наш соотечественник Б. М. Вул открыл новый сегнетоэлектрик - титанат бария BaTiO3. Несколько позже было показано, что сегнетоэлектрическими свойствами обладают титанаты других металлов, ряд цирконатов, танталатов и ниобатов (SrTiO3, PbZro3, NaTao3, KNbO3), а также твердые растворы на основе этих соединений.
Рассмотрим природу спонтанной поляризации в таких материалах на примере титаната бария. Элементарную ячейку кристаллической решетки этого материала можно представить следующим образом. В вершинах куба находятся ионы бария, по центрам граней куба находятся ионы кислорода, а в центре куба находится ион титана (рис. 32)
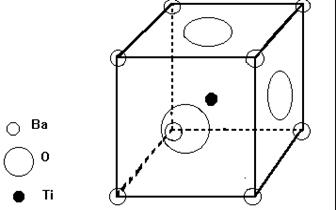 Рис. 32. Схема элементарной ячейки кристаллической решетки титаната бария.
Рис. 32. Схема элементарной ячейки кристаллической решетки титаната бария.
|
Поскольку между атомами титана, кислорода и бария осуществляется ионная связь кристаллическая решетка данного соединения упакована неплотно. Следовательно, ион титана может смещаться относительно центра элементарной ячейки. При смещении иона титана к какому либо иону (или группе ионов) кислорода, кулоновские силы удерживают ион титана в этом положении, и элементарная ячейка становится поляризованной. Поляризация одной элементарной ячейки приводит к появлению диполя, электрическое поле которого поляризует соседние элементарные ячейки. Таким образом, кристалл самопроизвольно (спонтанно) поляризуется. Повышение температуры приводит к активизации колебаний иона титана, и при равенстве энергии теплового движения этого иона с энергией электростатического взаимодействия с ионами кислорода элементарные ячейки кристалла деполяризуется. В итоге кристалл переходит из сегнетоэлектрического в параэлектрическое состояние. Температуру перехода принято называть температурой Кюри.
Важно отметить, что при температурах, меньших температуры Кюри, в отсутствии внешнего поля достаточно большие кристаллы сегнетоэлектриков не обладают электрическим моментом. Это обусловлено тем, что в случае, когда все дипольные моменты элементарных ячеек кристалла ориентированы одинаково, вокруг кристалла появляется электрическое поле. Потенциальная энергия такого кристалла резко возрастает. Для снижения потенциальной энергии кристалл разбивается на области (домены), в пределах которых дипольные моменты элементарных ячеек параллельны, но суммарные электрические моменты соседних доменов антипараллельны или перпендикулярны. Таким образом, суммарный электрический момент кристалла равен нулю.
При помещении сегнетоэлектрика в электрическое поле суммарные моменты диполей ориентируются по полю и поляризация сегнетоэлектрика возрастает (рис. 33)
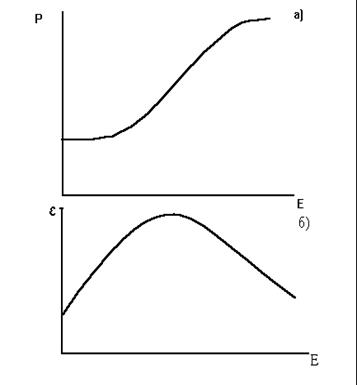 Рис. 33. Зависимости поляризации (Р) и диэлектрической проницаемости сегнетоэлектриков (e) от напряженности электрического поля (Е).
Рис. 33. Зависимости поляризации (Р) и диэлектрической проницаемости сегнетоэлектриков (e) от напряженности электрического поля (Е).
|
Рост поляризации приводит к росту отношения Р/Е, а следовательно, к росту диэлектрической проницаемости. Однако по мере роста напряженности поля прирост поляризации снижается, падает отношение P/E, и поэтому зависимость диэлектрической проницаемости от напряженности поля имеет куполообразный вид. У сегнетоэлектриков максимальные значения диэлектрической проницаемости достигают сотен тысяч единиц, соответственно, габариты конденсаторов из таких материалов могут быть весьма малыми.
Существенное влияние на диэлектрическую проницаемость оказывает температура. При повышении температуры кинетическая энергия ангармонических колебаний ионов возрастает, и электростатическая связь между ионами ослабевает. Внешнему полю легче перебросить ионы из одного положения в другое, соответственно, поляризация и диэлектрическая проницаемость возрастают. Максимум диэлектрической проницаемости наблюдается при температуре Кюри.
Легирование сегнетоэлектриков приводит к изменению энергии связи между ионами и дает возможность изменять температуру Кюри и величину диэлектрической проницаемости.
48.Рекрестализационный отжиг металлов
Холодная пластическая деформация вызывает изменение структуры металла и его свойств. Сдвиговая деформация вызывает увеличение плотности дефектов кристаллической решетки, таких как вакансии, дислокации. Образование ячеистой структуры происходит с изменением формы зерен, они сплющиваются, вытягиваются в направлении главной деформации. Все эти процессы ведут к тому, что прочность металла постепенно увеличивается, пластичность падает, т.е. возникает наклеп или нагартовка. Дальнейшая деформация такого металла невозможна, т.к. происходит его разрушение. Для снятия эффекта упрочнения применяют рекристаллизационный отжиг, т.е. нагрев металла до температур выше начала кристаллизации, выдержку с последующим медленным охлаждением. Температура нагрева зависит от состава сплава. Для чистых металлов температура начала рекристаллизации tp=0,4Тпл, ºК, для обычных сплавов порядка 0,6Тпл, для сложных термопрочных сплавов 0,8Тпл. Продолжительность такого отжига зависит от размеров детали и в среднем составляет от 0,5 до 2 часов. В процессе рекристаллизационного отжига происходит образование зародышей новых зерен и последующий рост этих зародышей. Постепенно старые деформированные зерна исчезают. Количество дефектов в кристаллической решетке уменьшается, наклеп устраняется, и металл возвращается в исходное состояние.
Рекристаллизационный отжиг заключается в нагреве холоднодеформированной стали выше t° начала кристаллизации, выдержке при этой t° и последующем медленном охлаждении. Большая часть работы затрачивается на пластическую деформацию металла, превращается в тепло, а ост часть аккумулируется в металле. О накоплении этой энергии свидетельствует увеличение плотности дефектов кристаллической решетки и рост напряжений. В результате пластической деформации металл приходит в термодинамически неустойчивое механическое состояние. В результате изменяется структура, повышается плотность дислокаций, что приводит к увеличению прочности. Это называется наклёп. Металл, таким образом, находится в энергетически неустойчивом состоянии. Он стремится вернуться в устойчивое состояние с меньшим уровнем свободной энергии. Чтобы в металлах могли произойти необходимые изменения их нагревают и проводят рекристаллизационный отжиг. В начале при нагреве до t°=0,2…0,3 от t°ПЛ без видимых изменений в структуре наблюдается восстановление некоторых свойств, начинает снижаться электрическое сопротивление и увеличиваться электропроводность. Для технически чистых металлов при достижении t°»0,4 от t°ПЛ начинается рекристаллизация. Рекристаллизационный отжиг используют в промышленности как первоначальную операцию перед холодной обработкой давлением (для придания металлу пластичности), как промежуточный процесс между операциями холодного деформирования (для снятия наклёпа) и как окончательную техническую обработку для придания изделию требуемых свойств
47. Пьезоэлектрики
Пьезоэлектриками называют диэлектрики, в которых под действием механических напряжений появляется поляризация, а под действием электрического поля пьезоэлектрики упруго деформируются. Таким образом, пьезоэлектрики являются электромеханическими преобразователями, преобразующими механическую энергию в электрическую и обратно.
Пьезоэлектрический эффект наблюдается в кристаллах, не имеющих центра симметрии, у которых при деформации ячейки происходит появление электрического момента. Заряды q, возникающие на поверхности пластин из пьезокристаллов пропорциональны приложенным силам.
| qik=dikFi, | (2.7) |
где: Fi- сила, действующая вдоль i-кристаллографической оси;
dir- пьезоэлектрический модуль - величина заряда, возникающего под действием единичной силы по направлению i на поверхности, перпендикулярной направлению k.
При приложении разности потенциалов в пьезоэлектрике возникает деформация, которая, в первом приближении, равна напряженности поля
| e=Dl/lo=likEi, | (2.8) |
где: lik- пьезоэлектрическая постоянная.
Пьезоэлектрическими свойствами обладают многие кристаллы, лишенные центра симметрии: кварц, турмалин, сегнетова соль и др. Часто используется пьезокерамика. Пьезоэлектрики нашли широкое применение для изготовления резонаторов, преобразователей колебаний и др.
46.Природа ферромагнетизма
Согласно гипотезе Ампера внутри атомов и молекул текут молекулярные токи, а следовательно, имеются магнитные диполи. По сути дела гипотеза Ампера блестяще подтвердилась, когда была понята электронная структура атома. Движение электронов вокруг ядер атомов является элементарными токами, создающими магнитные моменты.
Более строгое рассмотрение элементарных магнитных моментов свидетельствует о том, что у атома имеются магнитные моменты ядер, орбитальные магнитные моменты электронов и спиновые магнитные моменты электронов. Магнитные моменты ядер атомов ничтожно малы по сравнению с магнитными моментами электронов, поэтому их влиянием на магнитные свойства материалов можно пренебречь. Орбитальные магнитные моменты электронов также заметно меньше спиновых магнитных моментов. Поэтому магнитные свойства материалов в основном определяются спиновыми магнитными моментами электронов.
Согласно правилу Хунда заполнение электронных орбиталей производится таким образом, чтобы магнитный и механический моменты электронов были максимальны. У переходных металлов внутренние электронные орбитали (3d или 5f) заполнены не полностью. Поэтому у атомов таких элементом имеется значительный магнитный момент.
В том случае, когда внутренние орбитали атомов заполнены, не полностью происходит обмен электронами незаполненных орбиталей соседних атомов. При этом энергия атомов понижается на величину обменной энергии (Uобм). Величина обменной энергии зависит от квантовомеханической функции - обменного интеграла (А) и взаимной ориентации суммарных спиновых моментов соседних атомов:
Uобм = -А (s1s2) (3.2)
Обменное взаимодействие может привести к взаимной ориентации магнитных моментов соседних атомов. В зависимости от ориентации магнитных моментов соседних атомов все вещества делят на ферромагнетики, антиферромагнетики и парамагнетики. Рассмотрим влияние обменного взаимодействия на ориентацию магнитных моментов соседних атомов подробнее.
Обменный интеграл зависит от расстояния между соседними атомами (а) и от радиуса незаполненных орбиталей (r) или в обобщенном виде от отношения (а/r). Зависимость обменного интеграла от отношения а/r показана на рисунке 46.
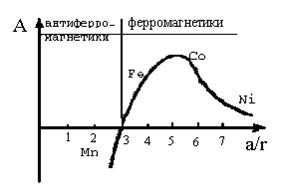 Рис. 46. Зависимость обменного интеграла (А) от расстояния между атомами, отнесенного к радиусу незаполненной электронной оболочки (a/r).
Рис. 46. Зависимость обменного интеграла (А) от расстояния между атомами, отнесенного к радиусу незаполненной электронной оболочки (a/r).
|
При отношении расстояния между атомами к радиусу незаполненных оболочек большем 3 обменный интеграл положителен и для того чтобы обменная энергия вычиталась из общей энергии системы необходимо параллельная ориентация спиновых магнитных моментов соседних атомов. Такие вещества являются ферромагнетиками. При отношении а/r меньшем 3 обменный интеграл отрицателен и для того чтобы энергия системы была минимальной скалярное произведение магнитных моментов соседних атомов должно быть отрицательным. В этом случае магнитные моменты соседних атомов антипараллельны и такие вещества принято называть антиферромагнетиками. При равенстве отношения а/r 3 обменная энергия нулевая и взаимная ориентация магнитных моментов произвольна. Такие вещества являются парамагнетиками.
Таким образом, для того чтобы вещество было ферромагнитным необходимо выполнение двух условий:
1). В состав материала должны входить атомы переходных металлов, обладающих большими магнитными моментами;
2). Отношение расстояния между атомами к радиусу незаполненных электронных оболочек должно превышать 3.
45.Природа высокой магнитной проницаемости пермаллоев.
44.Принципы термической обработки металлов Отжиг, закалка,отпуск
Для придания металлам и сплавам необходимых свойств их подвергают термической обработке.
1) Отжиг – техническая обработка, в процессе которой производится нагрев деталей из стали до требуемой t° с последующей выдержкой и медленным охлаждением в печи для получения однородной, равновесной, менее твердой структуры, свободной от остаточных напряжений
2) Закалка состоит в нагреве стали выше её t° фазовых превращений, выдержке для завершения всех превращений и охлаждений с целью получения при комнатной t° неравновесных структур, обеспечивающих более высокую прочность и твёрдость стали.
3) Отпуск – техническая обработка, представляющая собой нагрев закалённого сплава ниже t° фазовых превращений для приближения его структуры к более устойчивому состоянию.
43.Принципы получения материалов с высокой
Электропроводностью=27
42.Принципы получения материалов с высокой магнитной проницаемостью
Дата добавления: 2016-07-18; просмотров: 3734;











