Биологическое действие антимикробных пептидов
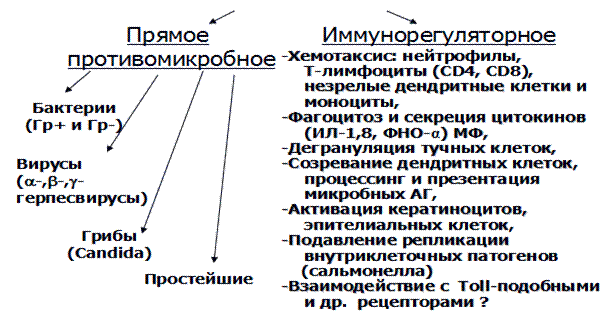
Первыми клетками, с которыми взаимодействуют проникшие во внутреннюю среду организма и не инактивированные гуморальными факторами микробы, являются фагоциты. До недавнего времени считалось , что процесс фагоцитоза, как неотъемлемая часть врожденного иммунитета носит полностью неспецифический характер. Однако в последние годы установлено, что фагоциты хозяина могут отличать микробы, как «чужое» от «своего», с помощью PRR (pattern-recognition receptors - патерн-распознающие рецепторы) рецепторов. Как уже отмечалось, лигандами PRR являются патоген-ассоциированные молекулярные образы (паттерны) - patogen-associated molecular patterns (РАМР).
РАМР синтезируются только микроорганизмами; их синтез отсутствует в клетках макроорганизма. Распознавание РАМР каким-либо из PRR является сигналом о наличие в организме хозяина инфекции.
Основные РАМР: липополисахарид (грам-отрицательные бактерии); пептидогликан и липотейхоевые кислоты (грам-положительные бактерии); бактериальная ДНК; двуспиральная РНК (вирусы); глюканы (грибы).
В таблице представлены основные виды патогенов, которые могут распознаваться PRR.
| PRR | Тип патогена |
| TLR-1 | Грам[+/-] |
| TLR-2 | Грам[+/-], грибы, вирусы |
| TLR-3 | вирусы |
| TLR-4 | Грам-[+/-], вирусы |
| TLR-5 | Грам-[+] |
| TLR-6 | Грам-[+], грибы |
| TLR-7 | Вирусы |
| TLR-8 | Вирусы |
| TLR-9 | Грам-[+/-] |
| TLR-10 | неизвестны |
| TLR-11 | Уропатогенные бактерии |
| NOD1 | Грам-[+/-] |
| NOD2 | Грам-[+/-] |
Взаимодействие PAMP с PRR, приводят к активации транскрипционного фактора NF-kB стимуляции продукции провоспалительных цитокинов (ИЛ-1,2,6,8,12,ФНО-α, ИФНγ, ГМКСФ), молекул адгезии, острофазовых белков, ферментов воспаления (NO-синтазы,ЦОГ и т.д.). Учитывая, что для реализации эффекта с сигнальных PRR не требуется пролиферации клеток и формирования антиген-специфического клона (необходимых при адаптивном иммунном ответе), эффекторные реакции после распознавания данными рецепторами PAMP наступают немедленно. Этот факт и объясняет высокую скорость врожденных иммунных реакций.

Рис. 18. Роль факторов врожденного иммунитета в противоинфекционном иммунитете
На клеточном уровне эффект реализуется в трех направлениях:
· активация фагоцитов и значительное усиление их эффекторного потенциала.
· активация наивных лимфоцитов и подготовка их к началу адаптивного ответа.
· активация антиген-специфических клеток адаптивного иммунитета: увеличение продукции Ig В-лимфоцитами, повышение их чувствительности к антигенной стимуляции, усиление киллерных функций Т-клеток.
Макрофаги, активированные бактериальными аг, образующимися в процессе фагоцитоза возбудителя, продуцируют цитокины: ФНОa, ИЛ- 1b, 8 и 12, a-интерферон, ГМ-КСФ и др., которые активируют новые популяции клеток, мигрирующие в очаг воспаления - моноциты, нейтрофилы, естественные киллеры.
Эти клетки также начинают продуцировать цитокины, вовлекая в процесс защиты все новые и новые клетки. Кроме того, в процессе расщепления микроба образуются микробные пептиды, которые макрофаг в комплексе с антигенами МНС представляет Т-лимфоцитам.
Это – важнейший этап, без которого невозможно развитие адаптивного иммунитета.
Важнейшим цитокином, продуцируемым активированными микрофагами в течение раннего индуцибельного ответа, является ИЛ-12, который активирует макрофаги, нейтрофилы и NK-клетки. Активированные фагоциты более интенсивно поглощают микробы, быстрее убивают их и переваривают. Главными защитниками организма от внеклеточных бактерий на стадии раннего индуцибельного ответа являются нейтрофилы, от внутриклеточных микробов - NK-клетки.
Нейтрофилы выполняя роль инициаторов воспаления, характеризуются двумя основными функциями:
1. Поглощают и убивают в первую очередь бактерии, процесс усиливается при опсонизации возбудителя С3b и Ig G, белками острой фазы.
Процесс переваривания и уничтожения осуществляется под действием цитокинов, продуцируемых макрофагами.
2. Сами являются мощными продуцентами цитокинов (ИЛ - 1β, 8, 12, ФНО – α, ГМ-КСФ и др.), выделяют факторы роста фибробластов – важны при репарации.
Приобретают способность привлекать в зону воспаления другие клетки, участвующие в восстановительных реакциях.
НК клетки – главные защитники организма от внутриклеточных микробов и вирусов на стадии раннего индуцибельного ответа.
Имеют две особенности:
1. Обладают цитотоксической активностью в отношении некоторых возбудителей (ряд вирусов, крептококков, опухолевых клеток), причём активность ЕК в отношении клеток может быть усилена в десятки и сотни раз под влиянием ИЛ – 12, α – ИФН, продуцируемых моноцитами, МФ, нейтрофилами и β – ИФН – синтезируемый фибробластами.
Под действием цитокинов индуцируется синтез НК клетками γ – ИФН.
В результате на ранней стадии индуцибельного ответа формируется защита от внутриклеточных паразитов.
2. НК клетки способны участвовать в общем каскаде цитокинов (α – ИФН, ГМ-КСФ, ИЛ – 3, 8 и др.).
Мутантные мыши, не имеющие Т и В лимфоцитов не чувствительны к листериям, но при отсутствии у мышей НК клеток животные гибнут в первые 2–3(4) дня после заражения.
Адаптивный иммунный ответ развивается при преодолении микробом факторов естественной резистентности и накоплении бактериальных антигенов в количестве, достаточном для инициации иммунного ответа.
Сущность гуморального иммунитета заключается в образовании популяции В – лимфоцитов, их трансформации в плазматические клетки и продукции Ig.
Антитела играют важную роль в защите организма от инфекций. Это проявляется ингибированием взаимодействия микроорганизмов с клетками эпителия дыхательных путей, мочеполовой системы, ЖКТ (секреторный Ig А); нейтрализацией токсинов (вирусных и бактериальных) и антигенов (Ig G); опсонизацией микроорганизмов (Ig G, меньше Ig А, М); лизисом под влиянием системы комплемента и IgМ антител преимущественно грамотрицательных микроорганизмов.
Ведущие анттигенспецифические протективные механизмы при различных инфекциях
| Возбудители | Локализация | Факторы гуморальной защиты | Факторы клеточной защиты |
| Вирусы | Преимущественно внутриклеточная (в цитоплазме) | IgG (при гриппе + IgА) | CD8+ клетки |
| Стафилококки, стрептококки | Внеклеточная | IgG- и IgМ | - |
| Сальмонеллы, коринебактерии, клостридии, нейсерии, трепонемы | Преимущественно внеклеточная | IgG- антитела | - |
| Риккетсии, микобактерии, хламидии | Внутриклеточная (в цитоплазме и везикулах) | - | CD4+ и CD8+ клетки, активированные макрофаги |
| Грибы, плазмодии, токсоплазмы | Внеклеточная, реже внутриклеточная | IgG- антитела | CD4+ клетки, активированные макрофаги |
| Шистосомы, лейшмании | Внутриклеточная, реже внеклеточная | - | CD4+ клетки, активированные макрофаги |
Антитела могут играть важную роль при вирусных инфекциях, особенно на ранних стадиях – препятствуют проникновению вирусов в чувствительные клетки (вакцинация против вируса полиомиелита способна защитить нейроны от воздействия вируса, но не способна помочь на более поздних этапах заболевания). Антитела способны играть и негативную роль, особенно на поздних этапах некоторых вирусных инфекций (грипп, респираторно-интерстициальная), когда образуются иммунные комплексы АТ – вирус, ведущие к развитию в организме осложнений – иммунокомплексные патологии (васкулит после гриппа).
Сущность Т иммунного ответа сводится к реакции образования антигенспецифических Т - лимфоцитов (Тх1,2, ЦТЛ, Т – клеток памяти). Клетки памяти характеризуются быстрой пролиферацией при действии специфического АГ с образованием большого количества клеток – эффекторов, синтезирующих много Ig и цитокинов – формирующих быстрый и сильный иммунный ответ. Сохраняются в организме длительно (даже пожизненно) (оспа, корь) – это лежит в основе поствакцинального иммунитета. Не передаётся по наследству и формируется в процессе жизни. Главной функцией ЦТЛ в противоинфекционной защите является уничтожение клеток инфицированных внутриклеточными паразитами (вирусы, микоплазмы, хламидии и др.). Тх1, помимо продукции цитокинов, «вооружающих» другие клетки, принимают прямое участие в уничтожении возбудителей, персистирующих и размножающихся в макрофагах. Активация последних посредством γ – ИФН приводит к гибели внутриклеточного возбудителя в фаголизосоме.
Ведущие механизмы противовирусного иммунитета:
· нейтрализация вируса опсонинами с последующим фагоцитозом и цитолизом.
· комплемент-зависимая цитотоксичность.
· цитотоксические Т-лимфоциты.
· макрофаги.
· NK клетки
Ведущие механизмы антибактериального иммунитета:
· фагоцитоз
· активация системы комплемента.
· IgA, sIgA - предотвращают адгезию микроорганизмов к поверхности слизистых.
· антигенспецифические антитела (IgM, IgG).

· антитоксический иммунитет.
· внутриклеточные формы микроорганизмов уничтожаются активированными лимфокинами макрофагами, ЦТЛ, NK.
Механизмы формирования вторичного иммунодефицита при инфекции:
· нарушение функции фагоцитов;
· лимфоцитопения и изменение субпопуляций Т-клеток (снижение Тх) при ВИЧ-инфекции;
· изменение продукции антител, медиаторов и др. (снижение продукции ИЛ-2, ИНФ при ВИЧ-инфекции, повышение ИЛ-1при ВПГ; подавление антителообразования – стафилококк);
· NK - дефицит, снижение функциональной активности (герпес-зоостер; вирус гриппа).
Дата добавления: 2016-07-18; просмотров: 2163;











