Периферические (внежелезистые) механизмы нарушения активности гормонов
Большую роль в развитии эндокринных и ряда других заболеваний играют периферические механизмы, определяющие активность уже выделившихся в кровь гормонов. Эта активность может изменяться либо в сторону ее повышения, либо снижения, что клинически проявляется гиперили гипофункцией соответствующей железы.
Очевидно, все выделившиеся из желез гормоны связываются в крови с определенными белками и циркулируют в двух формах - связанной и свободной. Из этих двух форм связанный гормон биологически неактивен. Активностью обладает только свободная форма гормона, которая и оказывает физиологическое действие в клетках-мишенях. Известно связывание белками тироксина, инсулина, гормона роста, стероидных гормонов. Так, например, в физиологических условиях в плазме крови кортизол и кортикостерон связаны белками более чем на 90%, и лишь незначительное количество этих кортикостероидов находится в свободном состоянии.
Общее количество циркулирующего тироксина в организме составляет: связанного - 1,0 мг; свободного - 0,001 мг при концентрации последнего в сыворотке крови 0,1 мкг/л. Таким образом, концентрация свободной формы гормона очень незначительна по отношению к связанной.
Механизм действия гормонов на уровне клеток-мишеней различен и сложен. В соответствии с современными представлениями
все гормоны по механизму их действия на клетки-мишени можно разделить на две группы. Одна группа гормонов управляет различными обменными процессами в клетке с ее поверхности, как бы на расстоянии, поэтому данную группу можно назвать гормонами «дистантного» (непрямого) действия.Сюда входят белковые и пептидные гормоны, факторы роста, катехоламины, а также ряд других лигандов. Эти гормоны связываются на поверхности клетки-мишени с соответствующим рецептором, что включает ряд биохимических процессов, приводящих к образованию вторичных посредников. Обычно это выражается в активации ферментовэффекторов (аденилатциклаза, гуанилатциклаза, фосфолипаза С) и накоплении цАМФ, цГМФ или диацилглицерола и инозинтрифосфата. Вторичные посредники, в свою очередь, запускают последующую цепь процессов, важнейшими звеньями которых являются активация протеинкиназ и фосфорилирование белковых субстратов. По такому механизму, в частности, катехоламины регулируют интенсивность гликогенолиза. Специфичность ответа клетки на тот или иной гормон определяется специфичностью рецептора, который связывается только со своим гормоном, а также природой специфических для клетки протеинкиназ и белковых субстратов.
Другая группа гормонов проникает в клетку, где оказывает свое действие. Эту группу можно обозначить как группу гормонов «непосредственного» (прямого) действия.Сюда входят андрогены, эстрогены, прогестины, кортикостероиды. Главным в действии стероидных гормонов является активация или торможение того или иного гена, что сопровождается усилением или угнетением образования соответствующего фермента. Однако ряд эффектов осуществляется другими путями, не связанными с влиянием на активность генов.
В механизме доставки стероида к генетическому локусу можно выделить три звена. Первое звено - связывание поступившего в клетку гормона с белком, находящимся в цитоплазме и выполняющим роль специфического рецептора для данного гормона. Второе звено - модификация комплекса «стероид + рецепторный белок». Эта модификация дает возможность осуществления третьего звена - проникновения стероида в комплексе с рецепторами в ядро клетки и избирательного соединения со специфическим участком хроматина.
Общий механизм влияния гормонов «непосредственного» действия можно проиллюстрировать на примере глюкокортикоидов
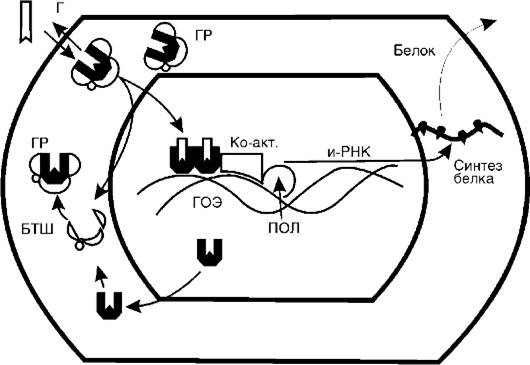 Рис. 20-6.Молекулярные механизмы действия глюкокортикостероидов (Г): ГР - глюкокортикоидный рецептор; БТШ - белок теплового шока; Ко-акт. - коактиваторы; ПОЛ - полимераза; ГОЭ - гормонотвечающий элемент
Рис. 20-6.Молекулярные механизмы действия глюкокортикостероидов (Г): ГР - глюкокортикоидный рецептор; БТШ - белок теплового шока; Ко-акт. - коактиваторы; ПОЛ - полимераза; ГОЭ - гормонотвечающий элемент
(рис. 20-6). Гормон свободно проникает в клетку и связывается со специфическими рецепторными белками цитоплазмы - глюкокортикоидными рецепторами (ГР). Очевидно, связывается неметаболизированный гормон, поскольку из стероидно-белкового комплекса удается выделить глюкокортикоид как таковой. Об этом свидетельствует и тот факт, что метаболиты кортизола не вызывают эффектов кортизола и конкурентно не угнетают его действия. Рецепторные белки обладают высоким сродством к стероиду, выраженной специфичностью и малой емкостью. Поэтому данный вид связывания называют специфическим. В зависимости от вида клеток количество рецепторов колеблется от 3000 до 5000 на одну клетку. Сравнение различных тканей одного вида животных показало, что связывание глюкокортикоида различно в разных тканях. Так, растворимая фракция клеток тимуса связывала в 3 раза больше триамсинолона, чем такие же фракции из коры головного мозга и тестикул.
Глюкокортикоидные рецепторы относятся к суперсемейству стероид/ядерных регуляторных протеинов, которые функционируют как лигандактивируемые факторы транскрипции. В цитоплаз-
ме ГР в несвязанном с гормоном состоянии представляют собой гетерогенные комплексы, состоящие из собственно рецептора и связанных с ним по крайней мере четырех белков теплового шока (БТШ). Роль последних заключается в поддержании конформации ГР в состоянии, подходящем для связывания гормона и предупреждения транслокации несвязанного с гормоном ГР в ядро. После связывания ГР с гормоном он освобождается из комплекса с белками теплового шока и перемещается в ядро. Здесь глюкокортикоидрецепторный комплекс превращается в димер и связывается в регуляторной части соответствующего гена с определенным участком ДНК, называемым гормонотвечающим элементом (ГОЭ). ГР-димер регулирует транскрипцию этого гена, вызывая либо активацию транскрипции, либо ее угнетение. При снижении уровня гормона и диссоциации гормонально-рецепторного комплекса в ядре ГР освобождается и возвращается обратно в цитоплазму, где снова образует комплекс с белками теплового шока.
Препараты глюкокортикоидных гормонов обычно применяют для подавления воспаления при многих заболеваниях (аутоиммунные процессы, бронхиальная астма и др.). Механизмы их антивоспалительного действия многообразны и реализуются через изменение регуляции активности многих генов, кодирующих образование провоспалительных цитокинов, ферментов и других продуктов, участвующих в развитии воспаления. Так, глюкокортикоиды:
1) усиливают экспрессию генов, которые кодируют образование ферментов, оказывающих угнетающее влияние на развитие воспаления (липокортин-1, нейтральная эндопептидаза в эпителиальных клетках слизистой дыхательных путей разрушают тахикинины, лейкоцитарный секретируемый ингибитор протеазы в слизистой дыхательных путей и др.);
2) угнетают экспрессию генов, кодирующих образование провоспалительных цитокинов (интерлейкины-1-6, гранулоцитарномакрофагальный колониестимулирующий фактор, фактор некроза опухоли и др.);
3) угнетают экспрессию генов, кодирующих образование энзимов, способствующих развитию воспаления (синтетаза оксида азота, индуцибельная изоформа циклоксигеназы-2);
4) угнетают экспрессию генов, кодирующих образование молекул адгезии (ICAM-I) и рецепторов для провоспалительных медиаторов (для вещества Р).
Одним из важных механизмов действия глюкокортикоидов является так называемое пермиссивное действие. Оно означает, что некоторые метаболические эффекты гормонов дистантного действия, о которых упоминалось выше, реализуются только в присутствии физиологических концентраций глюкокортикоидов.
Все гормоны, циркулирующие в организме, метаболизируются и выводятся из него. В основном метаболизм гормонов происходит в печени. Однако ряд гормонов метаболизируется и в других тканях.
В организме для каждого гормона существует равновесие между его секрецией, связыванием белками, действием в тканях-мишенях и метаболизмом в тканях. В поддержании такого равновесия большую роль играет механизм обратной связи. Нарушение любого из внежелезистых компонентов этого равновесия может приводить к таким изменениям, которые будут клинически проявляться как нарушение функции соответствующей железы.
Дата добавления: 2016-07-11; просмотров: 2067;











